
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Составление уравнений окислительно-восстановительных реакций
|
|
|
|
Внутримолекулярные окислительно- восстановительные реакции
Межмолекулярные окислительно-восстановительные реакции
Ок-ль и вос-ль нах-ся в разных в-вах; обмен электронами в этих р-ях происходит между различными атомами или молекулами:
S0 + O20 ® S+4O2-2
S - восстановитель; O2 - окислитель
Сюда же относятся р-ции между в-ми, в кот атомы одного и того же элемента имеют разные степени окисления
2H2S-2 + H2S+4O3 ® 3S0 + 3H2O
Во внутримолек р-ях ок-ль и вос-ль находятся в одной и той же молекуле. Внутримолек р-ции протекают при термич разложении в-в, содержащих окислитель и восстановитель.
2KCl+5O3-2 ® 2KCl-1 + 3O20Cl+5–ок-ль;О-2–вос- Диспропорционирование - ОВР, в кот один элемент одновременно повышает и понижает степень окисления.
Cl20 + 2KOH ® KCl+1O + KCl-1 + H2O
Электронный баланс - метод нах-я коэфф в ур-ях ОВР, в кот рассматривается обмен электронами между атомами элементов, изменяющих свою ст ок-я. Число электронов, отданное вос-лем равно числу электронов, получаемых окислителем. Уравнение составляется в несколько стадий:
1. Записывают схему реакции.
KMnO4 + HCl ® KCl + MnCl2 + Cl2 + H2O
2.Проставляют степени окисления над знаками элементов, которые меняются.
KMn+7O4 + HCl-1 ® KCl + Mn+2Cl2 + Cl20 + H2O
3.Выделяют элементы, изменяющие ст ок-я и опред число электронов, приобретенных ок-лем и отдаваемых вос-лем.
Mn+7 + 5ē ® Mn+2
2Cl-1 - 2ē ® Cl20
4.Уравнивают число приобрет и отдаваемых е-, устанавливая коэфф для соед, в кот присутствуют элементы, изменяющие ст ок-ия.
2Mn+7 + 10Cl-1 ® 2Mn+2 + 5Cl20
5.Подбирают коэффициенты для всех остальных участников реакции.
2KMn+7O4 + 16HCl-1 ® 2KCl + 2Mn+2Cl2 + 5Cl20 + 8H2O
Электронно-ионный баланс (метод полуреакций) метод нахождения коэфф, в котрассм-ся обмен е- между ионами в р-ре с учетом х-ра среды:
| 2Cl1- – 2ē ® | Cl20 | ||
| MnO41- + 8H+ | + 5ē ® | Mn2+ + 4H2O | |
| 7+ | 2+ |
10Cl- + 2MnO41- + 16H+ ® 5Cl20 + 2Mn2+ + 8H2O
(для уравнивания ионной полуреакции используют H+, OH- или воду)
Если изменение энергии Гиббса<0- то р-ция в прямом направлении.В школе изучение ОВР начинается в 8ом классе в теме растворы.
9. Электролиты – это вещества, которые проводят эл. ток если они находятся в растворенном или расплавленном состояниях. Носителями электричества в растворе являются анионы(-), катионы(+). При растворении солей, кислот, оснований в воде происходит диссоциация этих веществ с образованием эл. заряженных частиц катионов и анионов. Эл проводимость водных растворов пропорционально общей концентрации ионов в растворе.
i - изотонический коэффициент – показывает, во сколько раз осмотическое давление данного раствора больше нормального.
∆Ткип=i * KE*Cm
Аррениус ввел понятие степень электролитической диссоциации α – это отношение числа продиссоциирующих молекул на ионы к общему числу молекул.
α = (i-1)/(k-1) k – это число от2 до 4
электролитическая диссоциация вызывается взаимодействием полярных молекул растворителя с частицами растворимого вещества. Это взаимодействие приводит к поляризации связей и происходит образование ионов за счет ослабления и разрыва связей в молекулах растворяемого вещества.
электролиты:
а) сильные - 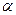 = 1: сильные кислоты,сильные основания, все соли – вещества которые при растворении в воде практически полностью распадаются на ионы.
= 1: сильные кислоты,сильные основания, все соли – вещества которые при растворении в воде практически полностью распадаются на ионы.
б) слабые - 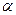 < 1: слабые кислоты, слабые основания, вода – вещества, частично диссоциирующие на ионы.
< 1: слабые кислоты, слабые основания, вода – вещества, частично диссоциирующие на ионы.
Константа диссоциации является важной характеристикой слабых электролитов так как указывает на прочность их молекул в данном растворе (для сильных электролитов константы диссоциации отсутствуют).
Закон разбавления Освальда: с уменьшением концентрации раствора степень диссоциации слабого электролита увеличивается 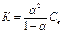
Изучение темы начинается в 8 классе в теме р-ры и продолжается углубляться на протяжении всего курса изучения химии в школе, особенно внимание уделяется в 10ом классе в теме химия р-ров.Здесь более подробно описывается тэд.
|
|
|
|
|
Дата добавления: 2015-06-28; Просмотров: 413; Нарушение авторских прав?; Мы поможем в написании вашей работы!