
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гальванический элемент: устройства, протекающие процессы на аноде и катоде
|
|
|
|
Гальваническими первичными эл-ми называют уст-ва для прямого преобразования хим энергии заключенных в них реагентов в электрическую. Реагенты (окислитель и восстановитель) входят в состав гальв эл-та и расходуются в процессе его работы. После расхода реагентов эл-т не может больше работать, Т.о. это источник тока одноразового действия, зн его еще называют первичным хим источником тока.
Емкость элемента — это кол-во электричества, кот источник тока отдает при разряде. Она опред-ся массой реагентов в эл-те, их эквивалентом и ст превращения.Важной хар-кой эл-та служит удельная энергия, т. е. энергия, отнесенная к единице массы или объема эл-та. Т.к при ув тока напряжение эл-та падает, то энергия и уд энергия эл-та также падают.
Гальванический элемент – состоит из 2 полуэлементов ОВ с-м, соед-х между собой Ме-м проводником.В качестве анодов обычно прим-ся электроды из цинка и магния, катодов — электроды из оксидов металлов (марганца, меди, ртути, серебра) и хлоридов (меди и свинца) на графите, а также кислородный электрод.
Процессы:
1.окисления на аноде(-)
2.восстановления на катоде(+)
3.движение эл-в во внешней цепи
4.движение ионов в растворе.
хим источники тока -уст-ва, выраб электрическую энергию за счёт прямого преобраз хим энергии ОВР. Первые хим источники созданы в 19 в. До 60-х гг. 19 в. хим источники тока были единственными источниками электроэнергии для питания электрических приборов и для лаб исследований. Основу хим источников тока составляют два электрода (один — сод ок-ль, другой — вос-ль), контактирующие с электролитом. Между электродами устан-ся разность потенциалов — электродвижущая сила (эдс), соответ свободной энергии ОВР. Действие хим источников тока основано на протекании при замкнутой внешней цепи пространственно разделённых процессов: на отриц электроде вос-ль окисляется, образ свободные электроны переходят по внешней цепи (создавая разрядный ток) к полож электроду, участвуют в р-ции вос-я ок-ля.В зав-ти от эксплуатационных особенностей и от электрохим с-мы хим источники тока делятся на гальв эл-ты, кот, после израсх реагентов (после разрядки) становятся неработоспособными, и аккумуляторы, в кот реагенты регенерируются при зарядке — пропускании тока от внешнего источника.(Свинцовые кислотные (+)PbO2 | H2SO4 | Pb(-),Кадмиево- и железо-никелевые щелочные (+)NiOOH | KOH | Cd, Fe(-) Серебряно-цинковые (+)Ag2O AgO | KOH | Zn(-)Никель-цинковые (+)NiOOH | KOH | Zn(-)Никель-водородные (+)NiOOH | KOH | H2(Ni) (-)
К важным и перспективным хим источникам относ топливные эл-ты (электрохим генераторы), способные длительно непрерывно работать за счёт постоянного подвода к электродам новых порций реагентов и отвода продуктов р-ции. Конструкция резервных хим ист-в позволяет сохранять их в неактивном состоянии 10—15 лет (Водородно-кислородные (+)O2(C,Ag) | KOH | H2(Ni)(-) Гидразино-кислородные (+)O2(C,Ag) | KOH | N2H4(Ni)(-)
С нач 20 в. Пр-во хим ист-в непрерывно расширяется в связи с разв автомоб транспорта, электротехники, растущим использованием радиоэлектронной и др. аппаратуры с автономным питанием. Пром-ть выпускает хим ист-ки тока, в кот преим-но использ ок-ли PbO2, NiOOH, MnO2 и др., вос-ми служат Pb, Cd. Zn и др.Ме, а электролитами — водные р-ры щелочей, кислот или солей. Лучшие хар-ки имеют разрабатываемые хим ист-ки на основе более активных электрохим с-м. в неводных электролитах (орг р-лях, расплавах солей или тв соед с ионной проводимостью) в кач-ве вос-лей можно применять щелоч Ме Топливные эл-ты позволяют исп-ть энергоёмкие жидкие или газообр реагенты. ЭЛЕКТРОЛИЗ, совок электрохим.ОВП, происх при прохожд эл тока через электролит с погруженными в него электродами. На катоде катионы вос-ся в ионы более низкой ст ок-я или в атомы, напр.: Fe3+ + eFe2+, Сu2+ + 2е Сu (е - электрон). Нейтральные мол могут участвовать в превращениях на катоде непосредственно или реагировать с прод-ми катодного процесса, кот рассм-ся как промеж в-ва электролиза. На аноде происходит ок-е ионов или мол, поступ из объема электролита или принадлежащих материалу анода; в последнем случае анод р-ся или ок-ся. Электролиз включает два процесса: миграцию реаг ч-ц под действием электрич. поля к пов-сти электрода и переход заряда с ч-цы на электрод или с электрода на ч-цу. Напр., при электролизе вго р-ра NaCl в миграции участвуют ионы Na+ и Сl+, на тв катодах Na+ не разряжаются, а протекает процесс разряда протонированных молекул воды: Н3О+ + е --> 1/2H2 + Н2О.
10 класс цели:Образов:продолжить формир-ть знания о хим.р-рах,ионныеур-я,;прод-тьформир. Хим.язык,эксперем.умения.Воспитат:прод-тьестественное
13. Теория электролитической диссоциации: основания-это вещества, диссоциирующие в водном растворе с образованием анионов одного видагидроксидионовОН-.
В общий вид: Основание -> Катион основания + Гидроксид – ион
NaOH  Na++ OH- Ba(OH)2 Na++ OH- Ba(OH)2  Ba2++ 2OH- NH3·H2O Ba2++ 2OH- NH3·H2O  NH4++ OH- NH4++ OH-
|
кислоты-это вещества, диссоциирующие в водном растворе с образованием катионов одного вида - катионов водорода Н+.
В общем виде уравнение электролитической диссоциации кислоты имеет вид: Кислота -> Катион водорода + Анион кислотного остатка
H2SO4  2H+ +SO42- CH3COOH 2H+ +SO42- CH3COOH  H+ = CH3COO- H+ = CH3COO-
|
Протолитическая (протонная) теория кислот и оснований (1923) независимо Й. Брёнстедом и Т. Лаури. понятие о кислотах и основаниях было объединено в единое целое, проявляющееся в кислотно-основном взаимодействии: А  В + Н+ (А — кислота, В — основание). Согласно этой теории кислотами являются молекулы или ионы, способные быть в данной реакции донорами протонов, а основаниями являются молекулы или ионы, присоединяющие протоны (акцепторы). Кислоты и основания получили название протолитов. Сущностью кислотно-основного взаимодействия- передача протона от кислоты к основанию.кислота, передав протон основанию, сама становится основанием, так как может снова присоединять протон, а основание, образуя протонированную частицу, становится кислотой. Таким образом, в любом кислотно-основном взаимодействии участвуют две пары кислот и оснований, названные Бренстедом сопряженными: А1 + В2
В + Н+ (А — кислота, В — основание). Согласно этой теории кислотами являются молекулы или ионы, способные быть в данной реакции донорами протонов, а основаниями являются молекулы или ионы, присоединяющие протоны (акцепторы). Кислоты и основания получили название протолитов. Сущностью кислотно-основного взаимодействия- передача протона от кислоты к основанию.кислота, передав протон основанию, сама становится основанием, так как может снова присоединять протон, а основание, образуя протонированную частицу, становится кислотой. Таким образом, в любом кислотно-основном взаимодействии участвуют две пары кислот и оснований, названные Бренстедом сопряженными: А1 + В2  А2 + В1. Одно и то же вещество в зависимости от условий взаимодействия может быть как кислотой, так и основанием (амфотерность). Например, вода при взаимодействии с сильными кислотами является основанием: H2O + H+
А2 + В1. Одно и то же вещество в зависимости от условий взаимодействия может быть как кислотой, так и основанием (амфотерность). Например, вода при взаимодействии с сильными кислотами является основанием: H2O + H+  H3О+, а реагируя с аммиаком, становится кислотой: NH3 + H2O
H3О+, а реагируя с аммиаком, становится кислотой: NH3 + H2O  NH4+ + OH−.
NH4+ + OH−.
Электронная теория:В теории Льюиса (1923 г.) на основе электронных представлений было ещё более расширено понятие кислоты и основания. Кислота Льюиса — молекула или ион, имеющие вакантные электронные орбитали, вследствие чего они способны приниматьэлектронные пары. Это, Н+, ионы металлов (Ag+, Fe3+), оксиды некоторых неметаллов (SO3, SiO2), ряд солей (AlCl3), а также такие вещества как BF3, Al2O3. Кислоты Льюиса, не содержащие ионов водорода, называются апротонными. Протонные кислоты рассматриваются как частный случай класса кислот. Основание Льюиса — молекула или ион, способные быть донором электронных пар: все анионы, аммиак и амины, вода,спирты, галогены. Примеры химических реакций между кислотами и основаниями Льюиса: AlCl3 + Cl− → AlCl4−. Кислотно-основные свойства гидроксидов элементов: Многие хим реакции протекают в водных р-рах:при определении кислотно-основных свойств исходят из ТЭД. По Аррениусу кислотно-основные свойства (КОС) определяются характером диссоциации веществ в водном растворе. КОС ОН- зависят от того, какая из двух связей в цепочке Э−О−Н является менее прочной. Если менее прочна связь Э−О, то ОН проявляет основные свойства, если О−Н − кислотные. Чем менее прочны эти связи, тем больше сила соответствующего основания или кислоты. Количественной мерой силыкислоты и основания является величина константы их электролитической диссоциации. Уамфотерных гидроксидов связи Э−О и О-Н сопоставимы по прочности, поэтому такие соединения проявляют свойства как кислоты, так и основания. Прочность связей Э−О и О−Н в гидроксиде зависит от распределения электронной плотности в цепочке Э−О−H. На последнюю наиболее сильно влияют степень окисления (СО) элемента Э и ионный радиус r.
Методика: Изучение кислот и оснований в школьном курсе химии начинается с 7 класса. Тема: Водород. В теме вводится понятие о кислотах. Меры предосторожности про работе с кислотами. Далее изучение продолжается в теме основные классы неорганических соединений. Изучаются состав и классификация кислот. Химические свойства кислот. Получение и применение кислот. Состав, свойства оснований. Понятие щелочей и нерастворимых оснований. Получение и применение. Далее в 8 классе в теме металлы изучается взаимодействие кислот с металлами. В 9 классе в теме неметаллы изучаются серная, соляная, азотная, угольная кислоты. Их свойства, получение, применение. В 10 классе в теме важнейшие классы неорганических веществ. Изучаются классификация, свойства, получение, применение кислот и оснований.
14. Водоро́д Три изотопа: 1H — протий (Н), 2H — дейтерий (D) и3H — тритий (радиоактивен) (T).H2. лёгкий безцв газ. В смеси с воздухом или О2 горюч ивзрывоопасен. Нетоксичен. Растворим в этаноле и ряде металлов: железе, никеле, палладии, титане,платине. Получение: В промышленности: Конверсия с водяным паром при 1000 °C: 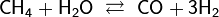
Пропуск паров воды над раскал коксом при тем-ре около 1000 °C:
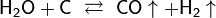
Электролиз водных растворов солей:

Каталитическое окисление кислородом:
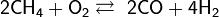
Крекинг и риформинг УВ в процессе переработки нефти. В лаборатории: Действие разб к-т на Ме Для провед р-ции чаще всего используют цинк и разбавленную серную кислоту:
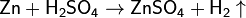
Взаимодействие кальция с водой:

Гидролиз гидридов:

Действие щелочей на цинк или алюминий:

С пом электролиза. При электролизе водных р-ров щелочей или к-т на катоде происх выделение водорода:
 Физические свойства: самый лёгкий газ, самая высокой теплопроводностью среди газообр в-в. При н.у. — газ без цвета, запаха и вкуса. хорошо растворим во многих Ме (Ni, Pt, Pd и др). С растворимостью Н2 в Ме связана его спос-сть диффундировать через них; диффузия через углеродистый сплав(сталь) иногда сопровож.разрушением сплава вследствие взаимод Н2 с С. Хим св-ва: при обычных т-рах реаг только с очень активными Ме:
Физические свойства: самый лёгкий газ, самая высокой теплопроводностью среди газообр в-в. При н.у. — газ без цвета, запаха и вкуса. хорошо растворим во многих Ме (Ni, Pt, Pd и др). С растворимостью Н2 в Ме связана его спос-сть диффундировать через них; диффузия через углеродистый сплав(сталь) иногда сопровож.разрушением сплава вследствие взаимод Н2 с С. Хим св-ва: при обычных т-рах реаг только с очень активными Ме: 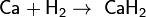 ,с единственным неметаллом — фтором, образуя фтороводород:
,с единственным неметаллом — фтором, образуя фтороводород:
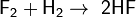
С бол-вом Ме и неМе реаг при >> Т или при другом воздействии
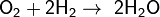
Он может «отнимать» О2 от нек оксидов: 
Вос-ные св-ва Н2: 
С галогенами образует галогеноводороды, При взаимод с акт Ме образ гидриды: 
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:

Оксиды вос-ся до Ме:  Молек Н2 широко прим-ся в орг синтезе для вос-я орг соед- р-ями гидрирования. проводят в присутствии катализатора при повышенных Р,Т. Гидриды — соед водорода с Ме и с имеющими меньшую электроотриц, Классификация:В зав-ти от хар-ра связи Н2 различ три типа гидридов:
Молек Н2 широко прим-ся в орг синтезе для вос-я орг соед- р-ями гидрирования. проводят в присутствии катализатора при повышенных Р,Т. Гидриды — соед водорода с Ме и с имеющими меньшую электроотриц, Классификация:В зав-ти от хар-ра связи Н2 различ три типа гидридов:
· ионные гидриды (солеобразные гидриды);
· металлические гидриды;
· ковалентные гидриды.
Вода́ — бинарное неорг соед. При н.у. - прозрачную жидкость, не имеет цвета (в малом объёме), запаха и вкуса. В ТВ сост-лед,в газообр — пар. сильнополярный р-ль В прир усл сод р-е в-ва Хим св-ва: наиб распррстр р-ль на планете.хим активное в-во. получение:

В ходе р-ций нейтрализ: 
Вос-ем МеО водородом: 
(при электролизе), под возд ионизирующего излучения, разлагается: 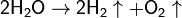 реаг при комн т-ре: с активными Ме
реаг при комн т-ре: с активными Ме
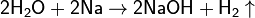
со фтором и межгалоидными соед,с солями, образ слабой к-той и слабым основанием, вызывая их полный гидролиз:
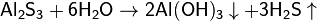
Методика: Изучение нач-ся в 7 кл в теме Вода. С-в мол, физ.св-ва Вода как р-ль. Хим св-ва. Р-ции нейтрализ. Значение воды. Далее в теме основные классы неорг соед. Изучают взаимод в-в с водой. В 8 кл в теме р-ры изучают воду как универсальный р-ль, строение молекулы воды. Жесткость воды и способы ее устранения. 9 кл тема: Неметаллы. Взаимод неметаллов и их соед с водой. 10 кл тема: Основные неорг соед. Взаимод разл классов в-в с водой. Также в теме: Химические реакции, химия растворов и неметаллы.
15. В гр галогенов входят фтор, хлор, бром, иод и астат.(VII гр. ПС.ns2np5.)во внеш эл-ом слое ат галогенов 7 е-, что предопределяет св-воприсоеде-.
Галогены явл-ся сильными ок-ми, непосредств взаимод почти со всеми ме и неме, за исключ О,С,N и благородных газов. Связь в галогенидах щелочных и щелочнозем ме ионная, в остальных - ковалентная. Галогены образ двухат непрочные мол. Легкость распада мол галогенов на ат - одна из причин их высокой хим акт-ти. В свободном сост галогены состоят из двухат молекул: F2, Cl2, Br2, I2. Астат - радиоакт эл-т,может быть получентолькоискусствпутем.
От F к I изм-ся физ св-ва галогенов: растет плотность, увел размеры ат, повышТкипиТпл.
С увел порядкового номера окисл спос-сть галогенов в свободном состоянии падает. Зн каждый предыдущий галоген вытесняет послед из его соед с ме и Н2,(2КСl + F2 = 2КF + Cl2)
Фтор - самый акт неме.проявляет одну ст ок-я -1, реаг почти со всеми ме (даже с золотом и платиной), и с неме. Р-р фтороводорода в воде - плавиковая к-та,ее соли-фториды. Хим путем F получить невозможно, зн исп-сяэлектролиз.Cl Br I проявляют ст ок-я -1 и +1. Ст ок-я -1 наиб хар-на для галогенов. Из-за высокой хим акт-ти существуют в связанном виде.
Хлор - газ желтоватого цвета с резким запахом, в 2,5 раза тяжелее воздуха. Тпл - 101°C, кип - 34,1°C. Неплохо растворим в воде. очень ядовит.широко исп-ся в пром-сти для отбелки тканей, получ HCl, белильной извести, ядохимикатов, для обеззараживания питьевой воды. Получение: ОкислCl- сильными ок-ми или электрич током:MnO2 + 4HCl=MnCl2 + Cl2 + 2H2O
Эл-з р-ра NaCl (промышл способ):2NaCl + 2H2O =H2 + Cl2 + 2NaOH
Хим св-ва: - сильный ок-ль. 1) Р-ции с металлами: 2Na + Cl2 = 2NaCl
2) Реакции с неметаллами: H2 + Cl2 –h= 2HCl
3) Реакция с водой: Cl2 + H2O = HCl + HClO
4) Реакции со щелочами: Cl2 + 2KOH –500C=KCl + KClO + H2O
5) Вытесняет бром и йод из галогеноводородных кислот и их солей. Cl2 + 2KI =2KCl + I2. Cl2 + 2HBr = 2HCl + Br2
Соед хлора: Хлористый водород. Физ св-ва: Бесцв газ с резким запахом, ядовитый, тяжелее воздуха, хорошо растворим в воде (1: 400).
t°пл. = -114C, t°кип. = -85°С.
Получение: 1) способ промышленный:H2 + Cl2 = 2HCl
2) Гидросульфатный способ (лаб):
NaCl(тв.) + H2SO4(конц.) =NaHSO4 + HCl
Хим св-ва: 1) Р-р HCl в воде,сильная кислота: HCl =H+ + Cl-
2) Реаг с ме, стоящими до водорода: 2Al + 6HCl =2AlCl3 + 3H2
3) с МеО: MgO + 2HCl = MgCl2 + H2O
4) с основ и NH3:HCl + KOH = KCl + H2,HCl + NH3 = NH4Cl
5) с солями: CaCO3 + 2HCl= CaCl2 + H2O + CO2
Образ белого осадка AgCl, нераств в мин кислотах исп-ся в качестве качественной р-ции для обнару; анионов Cl- в р-ре. Хлориды металлов - соли HCl, их получ взаимод ме с Cl или р-ми HCl с ме, их оксидами и гидроксидами; путем обмена с нек солями: 2Fe + 3Cl2 = 2FeCl3
CaO + 2HCl = CaCl2 + H2O
Pb(NO3)2 + 2HCl = PbCl2 + 2HNO3
Бол-во хлоридов р-мы в воде (за исключением хлоридов серебра, свинца и одновалентной ртути). Кислородсод кислоты хлора: Хлорноватистая кислота HCl+1O. H–O–Cl:Существует только в виде разбавленных водных р-в. Получение: Cl2 + H2O = HCl + HClO Хим св-ва: HClO - слабая к-та и сильный ок-ль:1) Разлаг, выделяя атомарный кислород
HClO –на свету=HCl + O; 2) Со щелочами дает соли - гипохлориты
HClO + KOH = KClO + H2O; 3) 2HI + HClO = I2 + HCl + H2O
Хлористая кислота HCl+3O2. H–O–Cl=O. Существует только в водн р-рах. Образ при взаимод Н2О2 с ClO (IV), кот получают из бертоллетовой соли и щавелевой кислоты в среде H2SO4:2KClO3 + H2C2O4 + H2SO4 =K2SO4 + 2CO2 + 2СlO2 + 2H2O;2ClO2 + H2O2 = 2HClO2 + O2
Хим св-ва: HClO2 - слабая к-та и сильный ок-ль; соли - хлориты:
1) HClO2 + KOH = KClO2 + H2O;2) Неустойчива, при хранении разлагается 4HClO2 = HCl + HClO3 + 2ClO2 + H2O
Хлорноватая кислота HCl+5O3:
Устойчива только в водн р-рах. Получение: Ba (ClO3)2 + H2SO4 = 2HClO3 + BaSO4 Хим св-ва: HClO3 - Сильная к-та и сильный ок-ль; - хлораты:HClO3 + KOH KClO3 + H2O
KClO3 - Бертоллетова соль; получ при пропускании хлора через подогретый (40C) раствор KOH:3Cl2 + 6KOH =5KCl + KClO3 + 3H2O
исп в кач ок-ля; при Т разлагается:4KClO3 –без кат=KCl + 3KClO4
2KClO3 –MnO2 кат=2KCl + 3O2
Хлорная кислота HCl+7O4
Бесцв жидкость, t°кип. = 25C, t°пл.= -101C.
Получение: KClO4 + H2SO4 = KHSO4 + HClO4
Хим св-ва: HClO4 - очень сильная к-та и сильный ок-ль;соли- перхлораты.1) HClO4 + KOH = KClO4 + H2O
2) При нагревании хлорная кислота и ее соли разлагаются:
4HClO4 –t° 4ClO2 + 3O2 + 2H2O. KClO4 –t°=KCl + 2O2
Методика: 9 кл, тема неметаллы. Цель: сформировать представление у учащихся о неметаллах. Задачи: образовательные:1.изучить положение галогенов в ПС Менделеева.2. изучить электронное строение, простые вещества, и свойства галогенов. 3.изучит соляную кислоту. Ее свойства. Применение и получение. Воспитательные: 1. Формирование естественно-научного мировоззрения учащихся. 2.установление причинно-следственных связей между строением, свойствами, получением, применением веществ. 3. Формирование интереса к предмету. 4. Воспитание трудолюбия, нравственности, ответственности. Развивающие: 1. Развитие логического мышления, памяти, речи. Межпредметная связь: физика. Основные понятия: неметаллы, химические свойства, строение электронных оболочек, физические свойства.
16. 6 гр ПС эл-в состоит из двух подгр: главной — кислород, сера, селен, теллур и полоний — и побочной — хром, молибден и вольфрам. В главной подгр выделяют подгруппу селена (селен, теллур и полоний). Все эл-ты главной подгр, кроме О, могут присоед по 2е-, образуя электроотриц ионы. Эл-ты главной подгр имеют на внш эл уровне по 6е- (s2р4). Атомы О имеют 2е- неспар. и не имеют d-уровня.Зн О проявляет в основном ст ок-я -2 и в соед со фтором +2.S Se Te Po имеют на внш уровне 6е- (s2p4), но у всех незаполненный d-уровень, зн они могут иметь до 6е- неспар и в соед проявлять ст ок-я — 2, +4 и +6. Зак-сть изменения акт-ти этих эл-ов такая же, как и в подгр галогенов: легче всего ок-ся теллуриды, затем селениды и сульфиды. Из кислородных соед серы наиб устойчивы соед серы (VI),для теллура — теллура (IV). Соед селена занимают промеж полож. Селен и теллур, их соед с нек ме (индием, таллием) обладают полупроводниковыми св-ми и широко исп-ся в радиоэлектронике. Соед Se Te очень токсичны. Они прим-ся в стекольной пром-ти для получ цв (красных и коричневых) стекол.
КИСЛОРОД - хим эл-т с ат номером 8, ат масса 16. В ПС эл-тов О расположен во 2 периоде в гр VIA. Прир О сост из смеси 3 стабильных нуклидов с масс числами 16, 17,18. Конфигурация внш слоя нейтрального невозбужд ат О 2s2р4. В соед проявляет ст ок-я –2 (валентность II) и, реже, –1 (валентность I). В свободном виде О— газ без цвета, запаха и вкуса. Физ и хим св-ва: в свободном виде встречается в виде 2 модифик О2 и О3 (озон). О2 — газ без цвета и запаха. Высокая прочность хим св между ат в мол О2 приводит к тому, что при Ткомн Огазообр химически довольно малоактивен. В природе медленно вступает в превращения при процессах гниения.О2 при Ткомн.способен реагир с гемоглобином крови (точнее с железом II гема),обеспечивает перенос О от органов дыхания к др органам. Со многими в-ми О2 вступает во взаимод без Т(со щелочными и щелочнозем ме),вызывает образ ржавчины на пов-ти стальных изделий. Без Т О2 реаг с белым фосфором, с нек альдегидами и др орг в-ми. При нагревании, хим акт-ть О2 резко возрастает. При поджигании реаг с взрывом с Н2, СН4, др горючими газами, с большим числом простых и сложных в-в.при нагревании в атмосфере кислорода или на воздухе многие простые и сложные в-ва сгорают, образ разл оксиды,: S+O2 = SO2; С + O2 = СО2
Если смесь О2 и Н хранить в стеклянном сосуде при Ткомн, то экзотерм р-ция образ воды: 2Н2 + О2 = 2Н2О + 571 кДж протекает крайне медленно; С N2 кислород реаг или при высокой т-ре (ок 1500-2000°C), или при пропускании через смесь N и O электр разряда. При этих условиях обратимо образуется оксид азота (II): N2 + O2 = 2NO
Возникший NO реаг с О2 с образ бурого газа: 2NO + О2 = 2NO2. Из неме О2 напрямую ни при каких условиях не взаимод с галогенами, из ме — с благородными ме Ag Au Pt Бинарные соед О2, в кот ст ок-я ат О = –2, наз оксидами. О2 образ соед, в кот ст ок-я= –1. Это — пероксиды. С акт-ми щелочными ме,О2 может образовывать также супероксиды,(КО2) (супероксид калия)В супероксидах ст ок-я О –1/2.С фтором О образ соед в полож ст ок-я. в соед O2F2 ст ок-я О +1, а в соед O2F — +2. Эти соед принадлежат не к оксидам, а к фторидам. Фториды кислорода можно синтезировать только косвенным путем(действуя F2 на разб водные р-ры КОН.) Нахождение в природе: О2 — самый распростран на Земле эл-т, на его долю приходится ок 47,4% массы тв земной коры. Морские и пресные воды содержат огромное кол-во связанного кислорода — 88,8% (по массе), в атмосфере содержание свободного О2 составляет 20,95 % (по объему). Эл-т входит в с-в более 1500 соед земной коры. Получение: в пром-ти получ за счет разделения воздуха при низких т-рах. Еще более чистый О можно получить при электролизе водных р-ров щелочей (NaOH или KOH) или солей кислородсод к-т (исп р-р Na2SO4). В лаборатории неб кол-ва не очень чистого О2 можно получить при нагревании KMnO4: 2KMnO4 = K2MnO4 + MnO2 + O2.
Более чистый О2 получ разложением Н2О2 в присутствии каталитических количеств тв MnO2: 2Н2О2 = 2Н2О + О2. О2 образ при сильном (выше 600°C) прокаливании NaNO3: 2NaNO3 =2NaNO2 + О2, при нагревании нек высших оксидов: 4CrO3 = 2Cr2O3 + 3О2;2PbO2 = 2PbO + О2;3MnO2 = Mn3O4 + О2.
Ранее О2 получ разлож бертолетовой соли в присутствии MnO2:2KClO3 = 2KCl + 3О2. Однако соль образ взрывчатые смеси,зн ее для получ О2 в лаб-ях теперь не используют.
Методика: 9 кл, тема неме. Цель: сформировать представление у учащихся о неметаллах. Задачи: образовательные:1.изучить положение О2 в ПС2. изучить электронное стр-е, простые в-ва, и св-ва О2. Воспит: 1. Формир естественно-научного мировоззрения учащихся. 2.установление причинно-следственных связей между стр-ем, св-ми, получ, применением в-в. 3. Формирование интереса к предмету. 4. Воспитание трудолюбия, нравственности, ответственности. Развивающие: 1. Развитие логич мышления, памяти, речи. Межпредметная связь: физика. Осн понятия: неме, хим св-ва, стр-е эл оболочек, физ св-ва.
17. S Ат номер 16 Ат масса 32,066 Изотопыстабильные 32, 33, 34, 36 нестабильные 31, 35, 37. сера, неметал хим эл-т, член сем-ва халькогенов (O, S, Se, Te и Po) - IVA подгр ПС. Сера необходима для роста растений и животных,входит в с-в живых орг-в и продуктов их разлож, ее много в яйцах, капусте, хрене, чесноке, горчице, луке, волосах. Применение. Ок половины ежегодного потребления серы идет на пр-во пром хим прод-ов,Н2SO4,SO2и CS2.S широко исп-ся в произв-ве инсектицидов, спичек, удобрений, взрыв в-в, бумаги, полимеров, красок, при вулканизации каучука.
Распространенность в природе. S встреч-ся в своб сост.имеются огромные запасы S в виде сульфидных руд. Св-ва. S- желтый порошок или хрупкой кристаллической массы без запаха и вкуса и нераств в воде.характерны неск аллотропных модификаций: Sкрист- ромбическая и моноклинная; аморфная - коллоидная (серное молоко) и пластическая; промеж аморфно-кристаллическая - сублимированная (серный цвет).
Хим св-ва. Сера -немет. На внш эл об-ке 6е-,легче присоед е- др эл-в, чем отдает свои. Со многими ме реаг с выд тепла. Она соед-ся почти со всеми неме, хотя не так энергично.
Соединения. SO2 – сернистый газ, сернистый ангидрид – бесцв газ с резким запахом, ядовит. Кислотный оксид. Связи-ков пол, sp 2-гибрид. Тяжелее воздуха, хорошо р-м в воде образ при раствор. H2SO3.
По кисл-ос-ым св-вам SO2 проявляет св-ва кис-го оксида, к-та проявляет св-ва кислот.По ОВ св-вам могут проявлять ОВ двойственность.С более сильными вос-ми соед ведут как ок-ли:
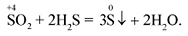
С более сильными ок-ми проявляют вос-ные св-ва:
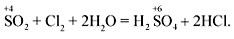
В промышленности диоксид серы получают:
• при горении серы:S + O2  SO2;
SO2;
• обжигом пирита и других сульфидов:4FeS2 + 11O2  2Fe2O3 + 8SO2
2Fe2O3 + 8SO2 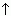 ,
,
К лабораторным методам получения относятся:
• действие сильн к-т на сульфиты:Na2SO3 + 2HCl = 2NaCl + SO2 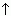 + H2O;
+ H2O;
• взаимоде H2SO4 с тяж ме:Cu + 2H2SO4 (конц.) = СuSO4 + SO2 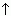 + 2H2O. Качественные реакции на сульфит-ион – обесцвечивание «йодной воды» или действие сильных мин к-т.Диоксид исп в произ-ве H2SO4, в холодильных установках, для отбеливания, дезинфекции, в пивовар и пищевых произ-х. H2SO3 существует только в разб р-рах/ слабая к-та, образ ср и кислые соли. К-та-хороший вос-ль, реаг с O2 оюраз H2SO4. области прим-я:обесцв шелка, шерсти, бумаги, древесной массы и др.
+ 2H2O. Качественные реакции на сульфит-ион – обесцвечивание «йодной воды» или действие сильных мин к-т.Диоксид исп в произ-ве H2SO4, в холодильных установках, для отбеливания, дезинфекции, в пивовар и пищевых произ-х. H2SO3 существует только в разб р-рах/ слабая к-та, образ ср и кислые соли. К-та-хороший вос-ль, реаг с O2 оюраз H2SO4. области прим-я:обесцв шелка, шерсти, бумаги, древесной массы и др.
SO3 – триоксид серы, или серный ангидрид, – это бесцв жидкость, кот при Т< 17 °С прев-ся в белую кристал массу. Ядовит.в виде полимеров связи-ков пол, sp 2-гибрид. Гигроскопичен, термически неустойчив. С водой реаг с сильным экзо-эффектом. Реаг с безводной серной кислотой, образ олеум. По кисл-осн св-вам- кисл оксид.По окисл-вос-ным св-вам выступ. сильным ок-лем, вос-ясь до SO2 или сульфитов.промеж. продукт при пр-ве к-ты.Триоксид серы сильно дымит во влажном воздухе и р-ся в воде, образ к-ту и выд тепло.исп в пр-ве к-ты и получ синт.орг в-в. Сероводоро́д -бесцв газ с запахом протухшихкуриных яиц и сладковатым вкусом.Плохо р-м в воде, хорошо — в этаноле. Ядовит. При больших конц взаимод со многими ме. Огнеопасен. Хим св-ва: мало раств-м, водный раствор H2S-очень слабой к-та:Реаг со щелочами.сильный вос-ль. В воздухе горит синим пламенем. реаг со многими др ок-ми, при его окислении в р-рах образ своб сера или SO42−,
Кач р-ей - взаимод с солями свинца, при кот образ чёрный осадоксульфида свинца. Сульфиды:Соли сероводородной к-ты. хорошо р-мы сульфиды щелочных металлов, аммония. Сульфиды остальных ме практ не р-мы,выпадают в осадок Многие ярко окрашены. прим в технике(полупроводники и люминофоры (сульфид кадмия, сульфид цинка), смазочные материалы (дисульфид молибдена) Получение:
· Взаимод разб к-т с сульфидами: 
· Взаимод 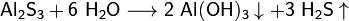
· Сплавлением парафина с серой.
Серная кислота – тяжелая маслянистая жидкость без цвета и запаха. Хорошо р-ма. Гигроскопична, ядовита, вызывает сильные ожоги. сильный электролит.образ 2 типа солей: сульфаты и гидросульфаты. Сульфаты акт-х ме терм уст-вы,сульфаты др ме разлаг даже при небольшом нагревании. Разбавленная, Концентрированная. Контактный метод получ серной кислотысостоит из трех стадий:
1) обжиг пирита:4FeS2 + 11O2  2Fe2O3 + 8SO2
2Fe2O3 + 8SO2 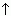 ;
;
2) окисление SO2 в SO3 в присутствии катализатора – оксида ванадия:

3) растворение SO3 в серной кислоте с получением олеума:
SO3 + H2O = H2SO4 + Q, n SO3 + H2SO4 (конц.) = H2SO4• n SO3.
Кач р-ция на сульфат-ион – взаимод с кат бария, выпадает белый осадок BaSO4.Ba2+ + SO42– —> BaSO4 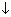 ,BaCl2 + Na2SO4 = BaSO4
,BaCl2 + Na2SO4 = BaSO4 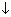 + 2NaCl.
+ 2NaCl.
Методика: 9 класс, тема неметаллы. Цель: сформировать представление у учащихся о сере и ее соединениях. Задачи: образовательные:1.изучить положение серы в ПС.2. изучить электронное строение, простые вещества, и свойства серы. 3.изучит серную кислоту. Ее свойства. Применение и получение. Воспитательные: 1. Формирование естественно-научного мировоззрения учащихся. 2.установление причинно-следственных связей между строением, свойствами, получением, применением веществ. 3. Формирование интереса к предмету. 4. Воспитание трудолюбия, нравственности, ответственности. Развивающие: 1. Развитие логического мышления, памяти, речи. Межпредметная связь: физика. Основные понятия: неметаллы, сера, химические свойства, строение электронных оболочек, физические свойства.
18. К главной подгрV гр ПС принадлежат N,P,As,Su,Vi. 5е-в нар слое ат, хар-ся как неме. Однако спос-ть к присоед е- выражена знач слабее, чем у соотв эл-в VI и VII гр.высшая положит окисленность эл-в -5, отриц - 3. связь эл-в с Н2 менее полярна,чем у эл-ов VI и VII гр.водородные соеди этих эл-ов не отщепляют в водном р-ре H+,знне обладают к-ми св-ми. Физ и хим св-ва эл-ов подгр азота изм-ся с увел. порядкового номера. нарастание мет св-в. Св-ва у мышьяка, сурьма приблизительно в равной степени обладает теми и другими св-ми,у висмута метал св-ва преобладают над немет. АЗОТ N, ХЭV гр ПС, ат номер 7, ат масса 14,0067; бесцв газ,без запаха и вкуса. Распространённость в природе. один из самых рас-ных эл-ов на Земле.В воздухе N2 сост 78,09% по объёму (или 75,6% по массе), не считая незнач примесей в виде аммиака и окислов. Прир соед-NH4Cl и разл нитраты.Внш эл об-ка ат состоит из 5е- (2 s 22 p 3). Чаще всего З-ковалентен за счёт неспар е-. Ст ок-я меняются от +5 (в N205) до -3 (в NH3). В обычных усл в своб состоянии образ мол N2, где N связаны 3 ков св. Физ и хим св-ва. легче воздуха. В воде менее р-им, чем О2. Лучше, чем в воде, р-им в нек УВ.
С литий, кальций, магний,взаимод при нагревании до сравнит невысоких т-р. С б-вом др эл-ов реаг при высокой т-ре и в присутствии кат. Хорошо изученыN2O, NO, N2O3, NO2 и N2O5. С Н2 азот соед только при высокой т-ре и в присутствии кат,образ NH3. Кроме аммиака, известны и др соед азота с Н: гидразин H2N-NH2, диимид HN-NH, азотистоводородная кислота HN3(H-N-NºN), октазон N8H14 и др.; С галогенами азот непосредственно не взаимод,зн все галогениды азот получают только косвенным путём.входит в с-в очень многих важнейших орг соед (амины, аминокислоты, нитросоединения и др.). Получение и применение. В лаборатории:при нагревании конц р-ра нитрита аммония: NH4NO2 - N2 + 2H2О. Технический способ- разделении предварительно сжиженного воздуха, кот затем подвергается разгонке. Осн часть добываемого свободного азота исп для пром-го произ-ва аммиака, кот затем в значит кол-вах перераб на азотную кислоту, удобрения, взрывчатые в-ва и т. д. цианамидный метод:при 1000оC карбид кальция реагирует со свободным азотом: СаС2 + N2 = CaCN2 + С. Образующийся цианамид кальция при действии перегретого водяного пара разлагается с выд аммиака: CaCN+ЗН2О=СаСО3+2NH3. Аммиа́к —NH3, при н.у. — бесцв газ с резким хар-ным запахом (запах нашатырного спирта). Плотность почти вдвое меньше воздуха, Мол имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атазота уч-ют в образ пол ков связей с 1s-электронами трёх атомов водорода (связи N−H), 4я пара внш е- яв-ся неподелённой, может образ ков связь по донорно-акцепторному мех-зму с Н+, образ ион аммония NH4+. мол аммиака обладает высокой полярностью,приводит к его хорошей р-сти в воде. В жидком аммиаке мол связаны между собой водор связями. Жидкий аммиак практ не проводит эл ток. Жидкий аммиак — хороший р-ль для очень большого числа орг,и для неорг соед. Тв аммиак — бесцв кубические кристаллы. Хим свойства
· присоединяет протон, образуя ион аммония;
Водный р-р аммиака («нашатырный спирт») имеет слабощел р-цию
Взаимод с к-ми даёт соотв соли аммония:
Аммиак является очень слабой к-той, способен образ с ме соли — амиды. Амиды щелочных ме получ, действуя на них аммиаком:
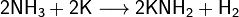
При нагревании аммиак проявляет вос-ные св-ва.он горит в атмосфере О, образ воду и азот. Ок-е воздухом на платиновом кат даёт оксиды азота, что исп в пром-ти для получ азотной кислоты: 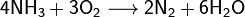

На вос-ой спос-ти NH3 основано применение нашатыря NH4Cl для очистки поверхности ме от оксидов при их пайке.
получают гидразин: 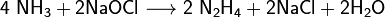
· Галогены образ с аммиаком оп взрыв в-ва — галогениды азота
· С галогеноалканами аммиак вступает в р-цию нуклеофильного присоед, образ замещённый ион аммония: 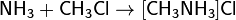
· С карб к-ми, их ангидридами, галогенангидридами, эфирами и др произв. даёт амиды.При 1000 °C аммиак реаг с углём, образ HCN и частично разлаг на азот и Н2.может реаг с СН4, образ синильную к-ту:
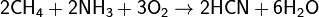
Методика: 9 кл, тема неме. Цель: сформ-ть представление о немет. Задачи: образ:изучить полож в ПС,эл стр-е, простые в-ва, и св-ва азота. 3.изучит аммиак.св-ва. Примен и получ. Воспит:Формир естественно-научного мировоз.устан причинно-следст св между стр-ем, св-ми, получ, примен в-в. 3. Формиров. интереса к предмету. 4. Воспитание трудолюбия, нравственности, ответственности. Развив: 1. Разв логич мышления, памяти, речи. Межпредм св: физика. Осн понятия:неме, хим св-ва, стр-е эл оболочек, физ св-ва.
|
|
|
|
|
Дата добавления: 2015-06-28; Просмотров: 828; Нарушение авторских прав?; Мы поможем в написании вашей работы!