
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Водородный показатель среды
|
|
|
|
РАСЧЁТНО-ГРАФИЧЕСКАЯ РАБОТА №2
ТЕОРЕТИЧЕСКИЕ ПОЯСНЕНИЯ
Водородный показатель среды водного раствора электролита рН равен взятому с обратным знаком десятичному логарифму активности ионов водорода в этом растворе:
рН = –lg ан+ (1)
Среда водного раствора электролита может быть: кислой, нейтральной или щелочной.
Носителями кислотных свойств являются ионы Н+, а основных – ион ОН–, поэтому в кислых растворах ан+ > аон-, а в щелочных – ан+ < аон-.
Растворы, в которых ан+ = аон- называют нейтральными.
При электролитической диссоциации воды образуется равное количество ионов H+ и ОН–:
2Н2О 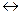 Н3О+ + ОН–,
Н3О+ + ОН–,
или упрощенно:
Н2О 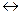 Н+ + ОН–.
Н+ + ОН–.
Константа диссоциации воды (Кд) при 250С (295 К) равна 1,8  10-16, а активность (концентрация) воды при той же температуре
10-16, а активность (концентрация) воды при той же температуре 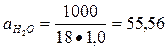 моль/л.
моль/л.
Тогда КД = 
 = 1,8 х10-16,
= 1,8 х10-16,
отсюда ан+  аон- = 1,8 10-16 х 55,56 = 10-14.
аон- = 1,8 10-16 х 55,56 = 10-14.
Величина KW = ан+  аон- называется ионным произведением воды (буква w от англ. слова water - вода). При 295К она составляет 10-14.
аон- называется ионным произведением воды (буква w от англ. слова water - вода). При 295К она составляет 10-14.
В нейтральных растворах активность ионов водорода равна активности гидроксо-групп: ан+ = аон- = 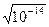 = 10-7 моль/л.
= 10-7 моль/л.
Следовательно, в:
· нейтральной среде рН= –lg ан+ = –lg 10–7= 7,
· кислой среде ан+ >10–7 моль/л, то и рН < 7,
· щелочной среде ан+ < 7 моль/л и рН > 7.
Наряду с показателем рН используется показатель рОН:
рОН = –lg аон-. (2)
Из выражения KW =10-14, при 295К можно показать, что
– lg KW = –lg ан+ = –lg аон –, следовательно
рН + рОН = 14.
При расчете водородного показателя среды водных растворов сильных кислот и оснований следует учитывать необратимость процесса их электролитической диссоциации, то есть степень диссоциации 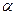 = 1:
= 1:
НС1 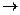 Н+ + Сl– и NaOH
Н+ + Сl– и NaOH 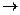 Na+ + ОН–.
Na+ + ОН–.
Концентрация ионов Н+ в растворах сильных кислот и концентрация ионов ОН- в растворах щелочей численно равны молярной концентрации (молярности) растворов. Например, CН+ в 0,001 М растворе НС1 равна 0,001 моль/л, а СОН- в 0,01 М растворе NaOH равна 0,01 моль/л.
Чтобы вычислить значение водородного или гидроксильного показателя среды (рН или рОН), нужно знать активность ионов H+ или ОН- (ан+ или аон -). ан+ = f 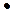 CH+ и аон - = f
CH+ и аон - = f  СОН-. Коэффициенты активности ионов находят по справочным таблицам как функцию ионной силы раствора.
СОН-. Коэффициенты активности ионов находят по справочным таблицам как функцию ионной силы раствора.
Более подробная информация представлена в примерах решения задач.
|
|
|
|
|
Дата добавления: 2015-06-29; Просмотров: 1059; Нарушение авторских прав?; Мы поможем в написании вашей работы!