
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение
|
|
|
|
Примеры решения типовых задач
Задача 1. Вычислите рН 0,01 М раствора HNO3.
1. Через активность иона водорода ( ан+ ). Метод целесообразно применять при расчете водородного показателя среды (рН) для кислот.
Активность иона водорода – функция концентрации иона водорода:
ан+ = fн+ 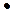 CH+ , (3)
CH+ , (3)
Коэффициенты активности ионов для растворов с различной ионной силой (I) приведены в приложении в таблице 15 учебника [3].
Ионную силу раствора считают по уравнению:
I = ½ 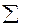 Ci*Zi 2, (4)
Ci*Zi 2, (4)
где Сi – концентрация ионов вещества i в растворе, моль/л.
Zi2 – заряд иона взятый по модулю в квадрате.
I = ½ (0,01  12 + 0,01
12 + 0,01  12)= 0,01,
12)= 0,01,
где CH+ = 0,01 моль/л; ZH+ =1;  = 0,01 моль/л,
= 0,01 моль/л,  = 1.
= 1.
Из таблицы 15 учебника [3] находим, что при I = 0,01 функция fH+ равна 0,92.
Далее рассчитываем активность иона водорода:
ан+ = 0,92  0,01 = 9,2
0,01 = 9,2  10-3 моль/л,
10-3 моль/л,
и по формуле (1) рН раствора:
рН = –lg 9,2  10-3 = 2,04.
10-3 = 2,04.
Ответ: рН (HNO3) = 2,04.
2. В случае расчета рН раствора щелочи целесообразно воспользоваться приведенной схемой для вычисления гидроксильного показателя среды рОН, а затем найти водородный показатель среды по формуле (5)
рН = 14 – рОН. (5)
3. При расчете водородного показателя среды водных растворов слабых кислот и оснований следует учитывать обратимость процесса их электролитической диссоциации (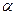 < 1):
< 1):
СНзСООН 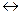 СНзСОО- + H+
СНзСОО- + H+
NH3  H2O
H2O 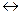 NH4+ + OH-
NH4+ + OH-
Н2СО3 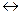 Н+ + НСО3-
Н+ + НСО3-
Концентрация ионов H+ в растворах слабых кислот и концентрация ионов ОН– в растворах слабых оснований численно равны концентрации продиссоциировавших молекул электролита, а не исходной концентрации раствора, как в случае сильных кислот и оснований.
Концентрацию продиссоциировавших на ионы молекул электролита (С) определяют, исходя из степени диссоциации:
С = α* Со , (6)
где Со – исходная концентрация молекул, моль/л,
α – степень диссоциации.
Степень диссоциации рассчитывают на основании закона разбавления Оствальда:
КД = 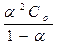 (7)
(7)
Значения КД, некоторых слабых электролитов приведены в справочных таблицах.
Примечание. Чаще пользуются формулой:
КД =  ,
,
или
 , (8)
, (8)
считая, что  «1. В случаях, когда расчет по упрощенному уравнению дает результат а > 0,1, вычисления повторяют, не пренебрегая величиной а в знаменателе дроби.
«1. В случаях, когда расчет по упрощенному уравнению дает результат а > 0,1, вычисления повторяют, не пренебрегая величиной а в знаменателе дроби.
Определив степень диссоциации (α) и концентрацию молекул, распавшихся на ионы (С), вычисляют рН или рОН раствора электролита, считая, что С = СН+, (кислота) или С = СОН- (основание).
При вычислении водородного или гидроксильного показателя среды раствора слабой кислоты или слабого основания можно считать, что  = СН+ и
= СН+ и 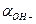 = СОН- в виду малых ионных сил растворов.
= СОН- в виду малых ионных сил растворов.
Задача 2. Вычислите рН 0,01 М раствора аммиака.
Решение. Поскольку раствор аммиака является слабой кислотой, то необходимо определить, сколько молекул NH3•Н2О распалось на ионы. Наиболее эффективно применять расчет через степень диссоциации.
1. Степень диссоциации NH3 • Н2О в 0,01 М растворе равна:
 =
=  .
.
2. Находим концентрацию молекул NH3•Н2О, распавшихся на ионы, и равную ей концентрацию ионов ОН-:
С= а* Со = 4,2  10-2
10-2  10-2 = 4,2
10-2 = 4,2  10-4 моль/л, С=CОН- = 4,2
10-4 моль/л, С=CОН- = 4,2  10-4 моль/л.
10-4 моль/л.
Определяем рОН и рН 0,01 М раствора аммиака:
рОН = -lg СОН- = -lg 4,2  10-4 = 3,33, рН = 14 - 3,33 = 10,67.
10-4 = 3,33, рН = 14 - 3,33 = 10,67.
Ответ: рН (NH3•Н2О)=10,67
Задача 3. Вычислите ионную силу 0,01М раствора H2SO4. Найдите активность иона Н+(ан+) и рН этого раствора. Оцените, настолько отличаются значения  и СН+?
и СН+?
Решение: Вычислим ионную силу раствора, предположив, что при диссоциации одной моли серной кислоты в разбавленном растворе будет образоваться 2 моля протона и 1 моль аниона SO42- (исходя из уравнения диссоциации).
 H2SO4 2H+ + SO42-
H2SO4 2H+ + SO42-
I = ½ 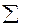 CiZi= ½ (0,02
CiZi= ½ (0,02  12 0,01
12 0,01  22) = 0,03
22) = 0,03
Из справочных данных для такого значения ионной силы находим:
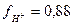 и, следовательно СН+= 0,88
и, следовательно СН+= 0,88  0,02 = 0,0176моль/л, и рН=1,75.
0,02 = 0,0176моль/л, и рН=1,75.
Если пренебречь значением коэффициента активности и считать, сто концентрация протона СН+= 0,02моль/л, тогда рН = - lg 0,02 = 1,7.
Таким образом, мы показали, что приравнивание активности протона к его молярной концентрации в разбавленных растворах кислот приводит к искажению значения рН на 0,05 единиц, что составляет 3% от величины рН.
Ответ: рН (H2SO4) = 1,75.
Задача 4. Смешали 100 мл 0,5м раствора соляной кислоты и 150 мл 0,5 М раствора гидроксида натрия. Вычислить рН образовавшегося раствора.
Решение: При смешении кислоты со щелочью происходит химическая реакция нейтрализации: HCl + NaOH 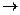 NaCl +H2O
NaCl +H2O
Вычислим количества веществ кислоты и щелочи в исходных растворах.
 0,5
0,5  0,1=0,05моль;
0,1=0,05моль;
 = 0,5
= 0,5  0,15=0,075 моль.
0,15=0,075 моль.
Следовательно, в смешанном растворе, после полной нейтрализации останется не нейтрализованные молекулы гидроксида натрия. Определим молярную концентрацию щелочи в образовавшемся растворе. Количества вещества избытка щелочи  0,075 – 0,05 = 0,025 моль. Объем раствор V(р-ра) = 0,1+ 0,15 = 0,25л. Концентрация щелочи
0,075 – 0,05 = 0,025 моль. Объем раствор V(р-ра) = 0,1+ 0,15 = 0,25л. Концентрация щелочи  =0,1моль/л.
=0,1моль/л.
рОН= -lg0,1=1; рН = 14 – рОН = 14-1=13.
Ответ: рН = 13.
Задача 5. Константа диссоциации синильной кислоты HCN составляет 6,2•10-10 (рКа = 9,21). Найдите: а) степень диссоциации; б) концентрацию ионов Н+ ; в) рН раствора, если концентрация раствора кислоты 0,1 моль/л.
Решение: Математическая связь между степенью диссоциации 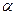 и константой диссоциации выражена в уравнение Оствальда, которое иногда называют законом разбавления:
и константой диссоциации выражена в уравнение Оствальда, которое иногда называют законом разбавления:
 =
= 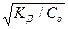
Как видно, при уменьшении концентрации электролита Со, дробь возрастает, что приводит к увеличению значения 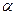 . Таким образом, экспериментально установлено, степень диссоциации электролита в растворе зависит от его концентрации, или иначе говоря, при разбавлении растворов степень диссоциации растворенного электролита растет. Этот закон записывают следующим образом:
. Таким образом, экспериментально установлено, степень диссоциации электролита в растворе зависит от его концентрации, или иначе говоря, при разбавлении растворов степень диссоциации растворенного электролита растет. Этот закон записывают следующим образом: 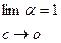 .
.
1) Вычислим степень диссоциации 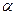 =
= 
2) Вычислим концентрацию протона: Н+ =  . Так как нам известно, что значение рКа = - lgK = 9,21, то удобнее преобразовать это уравнение так:
. Так как нам известно, что значение рКа = - lgK = 9,21, то удобнее преобразовать это уравнение так:
pH= -lgH+= - 0,5lgK - 0,5lgC = 0,5pK - 0,5lg0,1= 0,5  9,21 + 0,5 = 4,605+0,5=5,105.
9,21 + 0,5 = 4,605+0,5=5,105.
Ответ: рН = 5,105.
Варианты задач по теме 3.1.1. водородный показатель среды
1. Что называют степенью диссоциации электролита? Чему равна степень диссоциации сильных электролитов? Как она связана с концентрацией слабых электролитов и почему?
2. Закон разбавления Оствальда. Почему он так называется? Приведите физико-химическую трактовку этой зависимости.
3. В ряду электролитов NaOH, КОН, Н2О, СН3СООН, H2S, HNO3, HC1 подчеркните те, диссоциация которых в водных растворах протекает обратимо.
4. Составьте уравнения электролитической диссоциации уксусной и сероводородной кислот (две ступени). Запишите выражения соответствующих констант диссоциации.
5. Вычислите ионную силу 0,05 М раствора NaOH. Найдите активность иона ОН- (аон-) в этом растворе.
6. Рассчитайте концентрацию ионов ОН- в 0,05 М растворе аммиака.
7. Рассчитайте активность ионов ОН- в растворе, если ан+ = 10-2 моль/л.
8. Активность ионов ОН- в водном растворе равна 10-3 моль/л. Вычислите рН раствора.
9. Рассчитайте рН 0,05 М водного раствора HNO3.
10. Рассчитайте рН 0,05 М водного раствора КОН.
11. Найдите молярную концентрацию раствора HC1, рН которого 2,5. Найдите молярную концентрацию раствора NaOH, рН которого 12.
12. Зная константу диссоциации NH3•Н2О, найдите: а) степень диссоциации; б) концентрацию ионов ОН- ; в) рН раствора, если концентрация раствора аммиака 0,01 моль/л.
13. Учитывая только первую ступень диссоциации, вычислите водородный показатель среды 0,02 М раствора Н2СОз.
14. Сколько миллилитров 0,5 н. раствора HC1 нужно взять для приготовления 100 мл 0,01 н. HC1?
15. Смешали равные объемы растворов гидроксида натрия и соляной кислоты с концентрацией по 0,001 моль/л. Рассчитать рН образовавшегося раствора.
16. Смешали 100 мл раствора NaOH концентрацией 0,01 моль/л и 200мл раствора соляной кислот, концентрацией 0,005моль/л. Рассчитать рН образовавшегося раствора.
17. Смешали 100 мл раствора HCl, концентрацией 0,01 моль/л со 100 мл раствора NaOH концентрацией 0,02 моль/л. Рассчитать рН образовавшегося раствора.
18. Смешали 200 мл раствора HCl, со 100 мл раствора NaOH равных концентраций. Рассчитать рН образовавшегося раствора.
19. Вычислить рН водных растворов 0,01н гидроксида натрия, 0,1н раствора соляной кислоты и серной кислоты концентрацией 0,5 моль/литр.
20. Вычислить рН водного раствора, образованный смешением 50 мл 0,1 н раствора NаОН и 400 мл 0,01н раствора HCl.
21. Вычислите ионную силу 0,05 М раствора NaOH. Найдите активность иона ОН- (аон-) в этом растворе.
22. Рассчитайте концентрацию ионов ОН- в 0,05 М растворе аммиака.
23. Рассчитайте активность ионов ОН- в растворе, если ан+ = 10-2 моль/л.
24. Активность ионов ОН- в водном растворе равна 10-3 моль/л. Вычислите рН раствора.
25. Рассчитайте рН водных растворов 0,05 М HNO3 и 0,05 М КОН.
26. Найдите молярную концентрацию раствора HC1, рН которого 2,5. Считайте 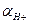 = СН+.
= СН+.
27. Найдите молярную концентрацию раствора NaOH, рН которого 12 (считайте, что диссоциация NaOH полная и CОН- = 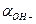 ).
).
28. Константа диссоциации NH4ОН составляет 1,8•10-5. Найдите: а)степень диссоциации; б) концентрацию ионов ОН- ; в) рН раствора, если концентрация раствора аммиака 0,01 моль/л.
29. Константа диссоциации уксусной кислоты составляет 1,8•10-5. Найдите: а)степень диссоциации; б) концентрацию ионов Н+ ; в) рН раствора, если концентрация раствора кислоты 0,01 моль/л.
30. Учитывая только первую ступень диссоциации, вычислите водородный показатель среды 0,5 М раствора Н3РО4.
31. Смешали равные объемы растворов гидроксида натрия и соляной кислоты с концентрацией по 0,001 моль/л. Рассчитать рН образовавшегося раствора.
32. Смешали 100 мл раствора NaOH концентрацией 0,01 моль/л и 200мл раствора соляной кислот, концентрацией 0,005моль/л. Рассчитать рН образовавшегося раствора.
33. Смешали 100 мл раствора HCl, концентрацией 0,01 моль/л со 100 мл раствора NaOH концентрацией 0,02 моль/л. Рассчитать рН образовавшегося раствора.
34. Смешали 200 мл раствора HCl, со 100 мл раствора NaOH равных концентраций (по 0,1 моль/л). Рассчитать рН образовавшегося раствора.
35. Вычислить рН водного раствора, образованный смешением 50 мл 0,1 н раствора NаОН и 400 мл 0,01н раствора HCl.
36. Вычислить рН водного раствора, образованного смешением равных объемов одинаковых концентраций растворов соляной кислоты и гидроксида натрия.
|
|
|
|
|
Дата добавления: 2015-06-29; Просмотров: 8183; Нарушение авторских прав?; Мы поможем в написании вашей работы!