
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения типовых задач. Задача 1. Пороги коагуляции золя электролитами оказались равными (моль/л): C(NaNO3) = 0,25; C[Fe (NO3)3] = 0,0005; C[Mg(NO3)2] = 0,02
|
|
|
|
Задача 1. Пороги коагуляции золя электролитами оказались равными (моль/л): C(NaNO3) = 0,25; C[Fe (NO3)3] = 0,0005; C[Mg(NO3)2] = 0,02. Какие ионы электролитов являются коагулирующими? Как заряжены частицы золя?
Решение: Все применяемые в качестве коагулянтов электролиты содержат нитрат анион. Если коагулирующей способностью обладали бы анионы коагулянта, то пороги коагуляции для всех электролитов должны были быть одинаковыми. Однако, в ряду Na+, Mg2+, Fe3+ значения порогов коагуляции резко уменьшаются. То есть, с ростом заряда катиона коагулянта порог коагуляции падает. Как известно, коагулирующей активностью обладают ионы, противоположно заряженные по отношению к коллоидной частице. Поэтому можно заключить, что коллоидная частица изучаемого золя имеет отрицательный заряд.
Ответ: коагулирующими являются ионы Na+, Mg2+, Fe3+. Коллоидная частица заряжена отрицательно.
Задача 2. Золь кремниевой кислоты Н2SiO3 был получен при взаимодействии растворов К2SiO3 и HCl. Напишите формулу мицеллы золя и определите, какой из электролитов был в избытке, если противоионы диффузного слоя в электрическом поле движутся к катоду?
Решение: Если противоионы диффузного слоя движутся к катоду, то они имеют положительный заряд, а коллоидная частица – отрицательный. Следовательно, потенциал образующими ионами в процессе мицеллообразования оказались отрицательно заряженные анионы SiO32-.
Из сказанного следует, что в избытке была взята кремневая кислота, а мицелла имеет формулу, приведенную ниже:
Ответ: { [n(H2SiO3)  m(SiO32-)
m(SiO32-)  2(m-x)K+]2x-
2(m-x)K+]2x-  2xK+ }.
2xK+ }.
Задача 3. Какой объем 0,0025 м КI надо добавить к 0,035 л 0,003 н Рb(NO3)2, чтобы получить золь иодида свинца и при электрофорезе коллоидная частица двигались бы к аноду. Напишите формулу мицеллы золя.
Решение: Так как коллоидная частица двигается к аноду, значит коллоидная частица заряжена отрицательно. Следовательно, при образовании золя в избытке оказался иодид калия, а мицелла имеет формулу:
{ [n(PbI2)  mI-
mI-  (m-x)K+]x-
(m-x)K+]x-  xK-}
xK-}
Пользуясь законом эквивалентов можно подсчитать объемы реагирующих растворов для полной нейтрализации: V1C1(1/z) = V2C2(1/z).
V(KI)=V[Рb(NO3)2]  C[1/zРb(NO3)2]/C(1/zKI) = 0,035
C[1/zРb(NO3)2]/C(1/zKI) = 0,035  0,003/0,0025=0,042л
0,003/0,0025=0,042л
где C(1/z) – молярная концентрация эквивалента, моль/л.
Ответ: 0,042 л.
Задача 4. Свежеполученный и очищенный осадок Al(OH)3 разделили на 3 части. К первой добавили небольшое количество растворов, содержащих (перечисление по порядку добавления) Al2(SO4)3, HCl и Н2SO4, соответственно. Во всех трех случаях образовались золи гидроксида алюминия. Напишите формулы мицелл образовавшихся золей. Какой заряд будут иметь гранулы?
Решение. При введении в раствор катионов алюминия, не границе раздела фаз осадок/раствор происходит адсорбция катионов алюминия на рыхлой и активной поверхности гидроксида алюминия. Таким образом, ядро из молекул гидроксида алюминия, заряжается положительно. К этому агломерату притягиваются противоположно заряженные сульфат анионы (в растворе имеются только сульфат анионы), которые формируют слой ионов внутренней обкладки. Таким образом, появляется двойной электрический слой с определенным электрическим потенциалом. При этом, число отрицательных зарядов привнесенные сульфат анионами, в сумме, меньше, чем суммарный положительный заряд катионов алюминия. Поэтому, образованная гранула – коллоидная частица имеет положительный заряд. К положительно заряженной грануле притягиваются противоионы – отрицательные сульфат анионы, которые формируют диффузный слой противоионов. Таким образом, при введении в раствор сульфата алюминия наблюдается частичное растворение осадка с переходом в раствор, где формируется гидрозоль гидроксида алюминия. Это явление называется химическая пептизация.
{[nAl(OH)3 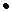 mAl3+
mAl3+ 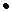 (m-
(m-  x)SO42-]3x+
x)SO42-]3x+ 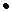
 x (SO42-)}.
x (SO42-)}.
Когда к раствору с осадком гидроксида алюминия добавили раствор серной кислоты, то произошла химическая реакция нейтрализации, в результате чего осадок гидроксида алюминия частичен растворяется, а в растворе, над осадком появляются катионы алюминия:
2Al(OH)3 + 3Н2SO4 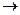 Al2(SO4)3 + 6Н2O
Al2(SO4)3 + 6Н2O
Наличие в растворе свободных катионов алюминия способствуют процессу химической пептизации (см. выше). В результате пептизации еще некоторая часть осадка гидроксида алюминия переходит в раствор, где формируются гидрозоли гидроксида алюминия точно такой же структуры (см. выше), что и в первом случае.
При введении в раствор соляной кислоты, наблюдаются те же процессы, что и во втором, только здесь в качестве противоионов вступают анионы хлора.
Al(OH)3 + 3НCl 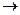 AlCl3 + 3Н2O
AlCl3 + 3Н2O
и далее формируется соответствующий гидрозоль:
{[nAl(OH)3 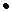 mAl3+
mAl3+ 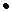 (m- 3x)Cl-]3x+
(m- 3x)Cl-]3x+ 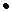 3x Cl-}.
3x Cl-}.
Во всех трех случаях заряд коллоидной частицы положителен, так как во всех случаях потенциал определяющим ионом являются катионы алюминия.
Ответ: 1) {[nAl(OH)3 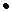 mAl3+
mAl3+ 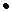 (m-
(m-  x)SO42-]3x+
x)SO42-]3x+ 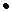
 x (SO42-)}.
x (SO42-)}.
2) аналогично 1.
3) {[nAl(OH)3 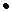 mAl3+
mAl3+ 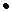 (m- 3x)Cl-]3x+
(m- 3x)Cl-]3x+ 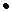 3x Cl-}
3x Cl-}
Варианты задач по теме 4.1. дисперсные системы
1. Являются ли коллоидные растворы гомогенными системами? Какова дисперсность коллоидных растворов?
2. Какие условия необходимо соблюдать при получении гидрозолей?
3. Как можно разрушать коллоидные системы. Назовите их и приведите примеры. Коагуляция, полог коагуляции и методы его определения.
4. Определение заряда коллоидных частиц методом электрофореза.
5. Физико-химическая трактовка явления светорассеивания (эффект Тиндаля) в коллоидных системах.
6. Каков состав ядра коллоидной частицы в растворе: а) сульфида сурьмы; б) гидроксида железа(Ш), иодида свинца (II) и бромида серебра?
7. Какие ионы могут быть заряд образующими в коллоидной частице золя: а) гидроксида железа(Ш); б) сульфида сурьмы?
8. Запишите формулу мицеллы золя: а) гидроксида железа (Ш) при смешении раствора хлорида железа ((Ш)) с менее концентрированным раствором гидроксида натрия.
9. Перечислите, какие методы коагуляции вам известны? В чем заключается явление коагуляции?
10. Почему при пропускании постоянного тока через раствор гидрозоля он коагулирует? Как можно использовать этот метод для определения заряда коллоидных частиц?
11. Что называют эффектом Тиндаля? Как используется этот эффект для идентификации коллоидных растворов?
12. Перечислите известные вам методы получения коллоидных растворов, опишите их суть.
13. Перечислите условия, при которых смешение растворов не приводит к образованию гидрозоля?
14. Почему образование гидрозоля не происходит, если смешать равные эквивалентные количества электролитов?
15. Какие гидрозоли надо смешать друг с другом, чтобы произошла совместная коагуляция этих золей? Приведите практический пример такой коагуляции.
16. Ионы какого заряда обладают коагуляционной активностью?
17. Почему на практике в водоканалах в процессах очистки воды используют сульфат алюминия или сульфат железа (III)?
18. Напишите формулу мицеллы сульфата бария, полученного сливанием равных объемов раствора BaCl2 и менее разбавленного раствора Н2SO4.
19. Какой объем 0,001М AsCl3 надо добавить к 0,02 л 0,003 М H2S, чтобы не произошло образование золи сульфида мышьяка, а выпал в осадок As2S3.
20. Напишите формулу мицеллы золя бромида серебра, полученного при взаимодействии разбавленного раствора нитрата серебра с избытком бромида натрия. Какой заряд гранула? Как изменится этот заряд, если в избытке окажется нитрат серебра?
21. Золь иодида серебра получен добавлением к 20мл раствора KI (СМ=0,01моль/л) 28 мл раствора AgNO3 (CМ=0,005 моль/л). Напишите формулу мицеллы полученного золя и определите направление движения гранулы золя при электрофорезе.
22. Свежеполученный и очищенный осадок Fe(OH)3 разделили на 2 части. К первой добавили небольшое количество FeCl3, а к другой НСl. В том и другом случае образовался золь гидроксида железа (III). Напишите формулы мицелл золя. Какой заряд будут иметь гранулы?
23. Какой объем 0,0002 М Fe(NO3)2 требуется для коагуляции 0,025л золя сульфида мышяка, если порог коагуляции равен 0,067 ммоль/л?
24. Золь кремниевой кислоты H2SiO3 был получен при взаимодействии раствора K2SiO3 и HCl. Напишите формулу мицеллы золя и определите какой из электролитов был в избытке, если противоионы в электрическом поле движутся к катоду?
25. Пороги коагуляции электролитов для некоторого гидрозоля равны: СNaNO=300 ммоль/л; CMgCl=25 ммоль/л; CNa SO =295 ммоль/л; CAlCl =0.5 ммоль/л. Какой заряд несут гранулы золя?
26. Напишите формулы мицелл золей иодида серебра, полученного при взаимодействии разбавленных растворов AgNO3 и KI при условиях: а) KI в избытке; б) KI в недостатке.
27. Для коагуляции 10 мл золя иодида серебра потребовалось 4,5мл раствора нитрата бария, молярной концентрацией 0,05 моль/л. Определите порог коагуляции электролита.
28. Свежеполученный и очищенный осадок As2S3 разделили на 2 части. К первой добавили небольшое количество разбавленного раствора хлорида мышяка, а к другой сульфид натрия. Напишите формулы мицелл образовавшихся золей.
29. Золь кремниевой кислоты H2SiO3 был получен при взаимодействии раствора K2SiO3 и HCl. Напишите формулу мицеллы золя и определите, какой из электролитов был в избытке, если гранулы гидрозоля в электрическом поле движутся к аноду?
30. Для коагуляции 20 мл золя сульфида мышяка (V) потребовалось 2,0мл раствора сульфата алюминия, молярной концентрацией 0,05 моль/л. Определите порог коагуляции электролита.
31. Напишите формулу мицеллы ортофосфата кальция, полученного сливанием равных объемов раствора СaCl2 и менее разбавленного раствора Н3РO4.
32. Золь бромида серебра получен добавлением к 50мл раствора KBr (СМ=0,02моль/л) 40 мл раствора AgNO3 (CМ=0,001 моль/л). Напишите формулу мицеллы полученного золя и определите направление движения гранулы золя при электрофорезе.
33. Золь гидроксида железа (III) получен смешиванием равных объемов 0,002 н NaOH и 0.0003 М Fe2(SO4)3. Какой знак имеют частицы образовавшегося золя? Напишите формулу мицеллы.
34. Как расположатся пороги коагуляции в ряду CrCl3; Ba(NO3)2; K2SO4 для золя ортофосфата серебра, гранулы которого при электрофорезе двигаются к аноду? Дайте мотивированный ответ.
35. Какой объем 0,0025 м KI надо добавить к 0,035л 0,003н Pb(NO3)2, чтобы получить золь иодида свинца и при электрофореза противоионы двигались бы к аноду. Напишите формулу мицеллы золя.
36. Напишите формулы мицелл гидрозолей ортофосфата кальция, полученного при взаимодействии разбавленных растворов ортофосфата натрия и хлорида кальция, при условии: а) при избытке ортофосфата натрия; б) при избытке хлорида кальция.
37. Для коагуляции 20 мл золя иодида свинца потребовалось 1,0 мл раствора хлорида алюминия, молярной концентрации 0,03 моль/л. Определить порог коагуляции этого электролита для золя иодида свинца.
38. Пороги коагуляции некоторого золя электролитами (нитраты натрия, магния и Fe3+ ) оказались равными (моль/л): 0.25; 0,02 и 0,0005 соответственно. Какие ионы электролитов обладают коагулирующим действием? Как заряжена коллоидная частица?
39. Для коагуляции 50,0 мл золя PbI2 потребовалось 1,0 мл раствора Al2(SO4)3 молярной концентрации 0,025 моль/л. Определить порог коагуляции этого электролита для золя иодида свинца.
40. Составьте формулу мицеллы золя гидроксида алюминия, полученного при глубоком гидролизе сульфата алюминия.
|
|
|
|
|
Дата добавления: 2015-06-29; Просмотров: 27328; Нарушение авторских прав?; Мы поможем в написании вашей работы!