
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения типовых задач. Задача 1: Определите степень окисления серы в соединениях: Н2S, Na2S2O3, H2SO3, H2SO4
Задача 1: Определите степень окисления серы в соединениях: Н2S, Na2S2O3, H2SO3, H2SO4.
Решение: При определении степени окисления (СО) элемента в молекуле исходят из предпосылок:
- молекула в целом электронейтральная;
- все связи в молекуле ионные;
- из двух соседствующих атомов отрицательный заряд приобретает тот, который более электроорицателен;
- СО между одинаковыми атомами равна нулю;
- водород (протон) всегда имеет СО +1, кроме в молекулах гидридов, где водород имеет СО равную -1;
- СО кислорода (кроме с фтором) всегда равна -2.
Таким образом:(Н+12Sх)о, 2(+1) + х = 0; х = -2;
(Na+12Sх2O-23)0 , 2(+1) + 2х + 3(-2) =0, 2х = 6 – 2= 4, х= 2;
(H+12SхO-23), 2(+1) + х + 3(-2) =0, х= 6- 2=4;
(H+12SхO-24), 2(+1) + х + 4(-2) =0, х= 8 - 2= 6;
Задача 2: Методами электронного баланса и полуреакций расставить коэффициенты в межмолекулярной окислительно-восстановительной реакции
FeSO4 + KMnO4 + H2SO4 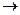 Fe2 (SO4)3 + MnSO4+ K2SO4 + H2O
Fe2 (SO4)3 + MnSO4+ K2SO4 + H2O
Решение: Определив степени окисления элементов, находящиеся в молекулах, участвующих в ОВР можно убедиться, что железо (II) окисляется в железо (Ш), а марганец (VII) восстанавливается до марганца (II).
Fe+2 – 1е- 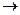 Fe+3, Mn+7 + 5е-
Fe+3, Mn+7 + 5е- 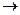 Mn+7
Mn+7
а) метод электронного баланса предусматривает уравнивание количества электронов в процессах окисления и восстановления. Так как в продуктах реакции имеем два атома железа, то при составлении ионных полуреакций необходимо электронный баланс вести из расчета двух ионов железа (II)):

 2Fe+2 – 2е- 2Fe+3 (х5)
2Fe+2 – 2е- 2Fe+3 (х5)

 Mn+7 + 5е- Mn+2 (х2)
Mn+7 + 5е- Mn+2 (х2)
 10Fe+2 + 2Mn+7 10Fe+3 + 2Mn+7
10Fe+2 + 2Mn+7 10Fe+3 + 2Mn+7
Переставляя соответствующие коэффициенты в уравнении реакции, получим:
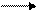 10FeSO4 + 2KMnO4 + H2SO4 5Fe2 (SO4)3 + 2MnSO4+ K2SO4 + H2O
10FeSO4 + 2KMnO4 + H2SO4 5Fe2 (SO4)3 + 2MnSO4+ K2SO4 + H2O
Коэффициенты перед серной кислотой можно вычислить как разницу между количеств сульфат анионов в продуктах и исходных реагентов реакции. (3х5 + 2 + 1) – 10 = 8
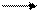 10FeSO4 + 2KMnO4 + 8H2SO4 5Fe2 (SO4)3 + 2MnSO4+ K2SO4 + H2O
10FeSO4 + 2KMnO4 + 8H2SO4 5Fe2 (SO4)3 + 2MnSO4+ K2SO4 + H2O
Коэффициенты для молекул воды получим из количеств протонов в серной кислоте. Так, из 2х8=16 водородов получатся 16: 2=8 молекул воды. Таким образом, можно написать окончательное уравнение окислительно-восстановительной реакции:
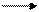 10FeSO4 + 2KMnO4 + 8H2SO4 5Fe2 (SO4)3 + 2MnSO4+ K2SO4 + 8H2O
10FeSO4 + 2KMnO4 + 8H2SO4 5Fe2 (SO4)3 + 2MnSO4+ K2SO4 + 8H2O
б) В методе полуреакций заряженные ионы- окислители и восстановители рассматриваются а составе катионов или анионов сложных молекул. Например, марганец (VII) в анионе (MnO4)2-:

 2Fe+2 – 2е-
2Fe+2 – 2е-  2Fe+3 (х5)
2Fe+3 (х5)

 (Mn+7O4)2 - + 8Н+ + 5е-
(Mn+7O4)2 - + 8Н+ + 5е-  Mn+2 + 4 H2O (х2)
Mn+2 + 4 H2O (х2)
 10Fe+2 + 2(Mn+7O4)2 - + 16Н+ 10Fe+3 + 5 Mn+2 + 8H2O или
10Fe+2 + 2(Mn+7O4)2 - + 16Н+ 10Fe+3 + 5 Mn+2 + 8H2O или
 10FeSO4 + 2KMnO4 + 8H2SO4 5Fe2 (SO4)3 + 2MnSO4+ K2SO4 + 8H2O
10FeSO4 + 2KMnO4 + 8H2SO4 5Fe2 (SO4)3 + 2MnSO4+ K2SO4 + 8H2O
Задача 3: Закончите реакцию и расставьте коэффициенты методом электронного баланса.
 Na2AsO3 + KMnO4 + KOH Ma2AsO4 +......
Na2AsO3 + KMnO4 + KOH Ma2AsO4 +......
Решение: После определения СО можно убедиться, что в данной реакции Na2AsO3 - восстановитель, так как As+4 -2е-  As+6. Из этого следует, что KMnO4 – окислитель. Известно, что в зависимости от рН среды Mn+7 может по - разному восстанавливаться, а именно:
As+6. Из этого следует, что KMnO4 – окислитель. Известно, что в зависимости от рН среды Mn+7 может по - разному восстанавливаться, а именно:

 рН >7 Mn+6 (MnO4)-2
рН >7 Mn+6 (MnO4)-2
 Mn+7 рН=7 Mn+4 (MnO2)
Mn+7 рН=7 Mn+4 (MnO2)
 рН<7 Mn+2
рН<7 Mn+2
Так как в нашем случае реакция протекает в присутствии щелочи, то рН>7 и продуктом реакции будет К2Mn2O4 и вода.
 Na2AsO3 + KMnO4 + KOH Na2AsO4 + К2MnO4 + H2O
Na2AsO3 + KMnO4 + KOH Na2AsO4 + К2MnO4 + H2O
Как было описано выше, расставим коэффициенты, методом электронного баланса:
 Mn+7 + е- Mn+6 (х 2)
Mn+7 + е- Mn+6 (х 2)
 As+4 - 2е- As+6 (х1)
As+4 - 2е- As+6 (х1)
Расчеты показывают, что в этой реакции коэффициенты не нужны, так как она уже уравнена.
Задача № 4. Закончите реакцию и расставьте коэффициенты методом электронного баланса.
 Na[Cr(OH)4] + Cl2 + NaOH Na2CrO4 +......
Na[Cr(OH)4] + Cl2 + NaOH Na2CrO4 +......
Решение: Необходимо определить окислитель и восстановитель. Для этого необходимо вычислить степени окисления атомов, входящих в состав исходных и конечных продуктов реакции. В молекуле Na[Cr(OH)4] степень окисления хрома равен +3, а в молекуле Na2CrO4 - + 6. Следовательно, в окислительно-восстановительной реакции, молекула Na[Cr(OH)4] является восстановителем, где атомы хрома окисляются, теряя 3 электрона:
 Cr3+ - 3e- Cr3+
Cr3+ - 3e- Cr3+
Если атомы хрома отдают электроны, следовательно, другие атомы принимают эти электроны, то есть восстанавливаются. Необходимо, путем логических соображений определить, какие атомы могут восстанавливаться?
Легко догадаться, что эти электроны переходят к молекуле хлора, которая, восстанавливаясь, является окислителем.
 Cl2 + 2е- 2Cl-
Cl2 + 2е- 2Cl-
Таким образом, мы определили окислитель и восстановитель в данной реакции. Остается определить, в какое соединение переходят молекулы хлора после восстановления. Так как в реак4ции участвуют молекулы гидроксида натрия, то ионы CI- в реакционной среде находятся в виде хлорида натрия. теперь мы можем написать молекулярное уравнение окислительно - восстановительной реакции:
 Na[Cr(OH)4] + Cl2 + NaOH Na2CrO4 + NaCl + H2O
Na[Cr(OH)4] + Cl2 + NaOH Na2CrO4 + NaCl + H2O

 Составим электронный баланс.
Составим электронный баланс.
 Cr3+ - 3e- Cr3+ 3 2
Cr3+ - 3e- Cr3+ 3 2
 Cl2 + 2е- 2Cl- 2 3
Cl2 + 2е- 2Cl- 2 3
Расставим коэффициенты:
 2Na[Cr(OH)4] + 3Cl2 + 8NaOH 2Na2CrO4 + 6NaCl + 8H2O
2Na[Cr(OH)4] + 3Cl2 + 8NaOH 2Na2CrO4 + 6NaCl + 8H2O
Задача № 5. Закончите реакцию и расставьте коэффициенты методом электронного баланса.
 KBrO KBr +.......
KBrO KBr +.......
Решение: В отличие от предыдущей задачи, здесь и окислитель и восстановитель находятся в одной молекуле. Такие реакции относятся к окислительно - восстановительным реакциям внутримолекулярного диспропроционирования. То есть, один и тот элемент является и окислителем и восстановителем. Такое может быт у поливалентных элементов, которые в реагирующей молекуле находятся в промежуточной степени окисления.
В данном случае, таки элементом является бром, атомы которого в молекуле гипобромида калия обладают степенью окисления +1. Известно, что бром способен проявлять степени окисления от +7 до -1. Наличие одного продукта в реакции, бромида калия показывает, что один атом брома восстанавливается, принимая 2 электрона. Следовательно, другой атом брома восстанавливается, отдавая эти электроны. При этом, возможны различные варианты, так как атом брома может восстанавливаться до степени окисления +3,+5,+7. Поэтому, эта задача может иметь несколько вариантов решений. Предположим, что атом брома восстанавливается до степени окисления +5. Тогда можем составить электронный баланс, предположив, что образуется калиевая соль НВrО3 кислоты - КВrО3.

 Br+1 + 2e- Br -1 2 3
Br+1 + 2e- Br -1 2 3
 Br+1 - 6e- Br +5 6 1
Br+1 - 6e- Br +5 6 1
В случаях с реакциями диспрпорционирования, коэффициенты расставляют, начиная с правой стороны. То есть, коэффициент 3 ставится перед продуктом, где бром находится в степени окисления -1.А перед продуктом, в котором бром находится в степени окисления +5, коэффициент не ставится, так как его коэффициент равен 1. Тогда легко убедиться, что в правой стороне имеем 4 атомов калия и столько же брома. Поэтому, в левой стороне необходимо расставить коэффициент 4. Однако, при этом не будут уравнены атомы кислорода. Таким образом, предполагаемая реакция не может быть осущ  ествлена без участия других веществ (например вода.)
ествлена без участия других веществ (например вода.)
 4KBrO 3KBr + КВrО3.
4KBrO 3KBr + КВrО3.
Предположим, что атом брома окисляется до степени окисления +7 и образуется пербромат калия КBrO4.


 Br+1 + 2e- Br-1 2 4
Br+1 + 2e- Br-1 2 4
 Br+1 - 8e- Br+7 8 1
Br+1 - 8e- Br+7 8 1
Аналогично выше описанному, расставим коэффициенты и убедимся, что этот вариант тоже не приемлем:
 5KBrO 4KBr + КВrО4.
5KBrO 4KBr + КВrО4.
Рассмотрим вариант, когда атом брома окисляется до степени окисления +3, то есть образуется соль КBrO2:
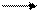

 Br+1 + 2e- Br-1 2 2
Br+1 + 2e- Br-1 2 2
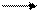 Br+1 - 4e- Br+3 4 1
Br+1 - 4e- Br+3 4 1
 3KBrO 2KBr + КВrО2.
3KBrO 2KBr + КВrО2.
Таким образом, эта реакция не может быт реакцией внутримолекулярного диспропорционирования.
Остается предположить, что это внутримолекулярная окислительно-восстановительная реакция, где окислитель и восстановитель находятся в одной молекуле, но представляют собой разные атомы, то есть атомы кислорода и брома. Тогда:


 Br+1 + 2e- Br-1 2 2
Br+1 + 2e- Br-1 2 2
 2О-2 - 4e- О2о 4 1
2О-2 - 4e- О2о 4 1
2KBrO 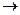 2KBr + О2.
2KBr + О2.
Варианты задач по теме 4.2.1 Окислительно-восстановительные реакции
|
|
Дата добавления: 2015-06-29; Просмотров: 3039; Нарушение авторских прав?; Мы поможем в написании вашей работы!