
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения типовых задач. Задача 1. Потенциал водородного электрода равен - 0,145 В
|
|
|
|
Задача 1. Потенциал водородного электрода равен - 0,145 В. Определите рН раствора и концентрацию ионов водорода в растворе.
Решение: Воспользуемся уравнением Нернста:
Е = Е о+ (RT/nF)lnaН+;
Подставляя цифровые значения констант в уравнение (n=1 и ЕоН+=0) получим:
- 0,145 = ЕоН+ + 0,059lg[H+];
lg[H+]; = - 0,145/0,059 и [Н+] = 10-2,45 моль/л.
Для расчета рН подставим значение концентрации протона в уравнение
рН = - lgН+ = - lg 10-2,45 = 2,45.
Ответ: рН = 2,45; [Н+] = 10-2,45 моль/л.
Задача 2. Никелевый и кобальтовый электроды опущены соответственно в растворы Ni(NO3)2 и Co(NO3)2. В каком соотношении должны быть концентрации ионов этих металлов, чтобы потенциалы обоих электродов были одинаковы?
Решение: По условии задачи ЕNi= ECo, c учетом n=2 получим:
ЕоNi2+ + 0,0295lg [Ni2+]= Ео Со2+ + 0,0295lg [Со2+]
Подставляя значения ЕоNi2+ = - 0, 250В, ЕоСо2+ = - 0,277В получим:
lg ([Ni2+]/[Со2+]) = 0,027 и ([Ni2+]/[Со2+]) = 100,027 = 1,064
Ответ: ([Ni2+]/[Со2+]) = 1,064.
Задача 3. Составьте схемы двух гальванических элементов, в одном из которых цинк - отрицательный, а в другом - положительный электрод.
Решение: В гальванических элементах отрицательным электродом является анод, то есть на нем происходит процесс анодного окисления.
Zn- 2e- 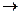 Zn2+ (окисление): Ео(Zn /Zn2+) = -0, 763В;
Zn2+ (окисление): Ео(Zn /Zn2+) = -0, 763В;
Следовательно, необходимо подобрать такой электрод, который по отношению с цинковым оказался бы положительное. Таким могут оказаться все электроды с Ео(Ме /Меn+) > - 0,763B, например, медный электрод: Ео(Cu/Cu2+) = + 0, 337В. Таким образом первый гальванический элемент, где цинк-анод будет медно-цинковый элемент с ЭДС = 1,1В (см. выше текст, теоретическая часть).
Для того чтобы цинк был положительным электродом, катодом, необходимо, чтобы Ео(Ме /Меn+) < - 0,763В. Для этой цели могут быть использованы алюминовый (-1, 662В), марганцевый (-1,18В). Для последнего случая напишем напиши химические процессы на электродах:
Zn 2+ + 2e - 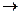 Zno; Mno -2e-
Zno; Mno -2e- 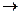 Mn2+
Mn2+
Восстановление (катод) Окисление (анод)

 Схема такого гальванического элемента может быть представлена в следующем виде:
Схема такого гальванического элемента может быть представлена в следующем виде:
 Mn /Mn2+ // Zn2+ /Zn
Mn /Mn2+ // Zn2+ /Zn
Варианты задач по теме 4.2.2. гальванический элемент
1. Охарактеризуйте проводники и диэлектрики.
2. Дайте определение понятиям: проводник, электрод, элемент.
3. Что такое гальванический элемент?
4. Как называются положительно и отрицательно заряженные полюса гальванического элемента и какие процессы на них происходят?
5. Почему в гальваническом элементе анод имеет отрицательный заряд, а в электролизере положительный?
6. В чем различие и сходство катодов в гальваническом элементе и электролизере?
7. Почему в катодной части электролизера фенолфталеин окрашивается в розовый цвет?
8. Что такой электролизер и чем он принципиально отличается от гальванического элемента?
9. Почему при смешении растворов катодных и анодных пространств электролизера розовая окраска фенолфталеина исчезает?
10. Магниевую пластинку опустили в раствор ее соли. При этом электродный потенциал магния оказался равен -2,41 В. Вычислите концентрацию ионов магния в моль/л.
11. При какой концентрации ионов Zn2+ (моль/л) потенциал цинкового электрода станет на 0,015 В меньше его стандартного электродного? (0,3 моль/л)
12. При какой концентрации ионов Cu2+ (в моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного элемента? Составьте схему, напишите электронные уравнения электродных процессов и вычислите э.д.с. гальванического элемента состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией [Mg2+]=[Cd2+ ]= 1,0 моль/л. Изменится ли величина э.д.с., если концентрацию каждого из ионов понизить до 0,01 моль/л?
13. Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом- анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на электродах.
14. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению:
Ni + Pb(NO3)2 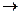 Ni(NO3) 2 + Pb
Ni(NO3) 2 + Pb
15. Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если [ Ni 2+] =0,01 моль/л; [Pb2+ ] = 0,0001 моль/л.
16. Вычислите потенциал железного электрода, опущенного в раствор, содержащий 0,0699г FeCl2 в 0,5 литре воды.
17. Определите электродный потенциал меди, погруженный в раствор 0,0005н нитрата меди (II).
Рекомендуемая литература
1 Глинка, Н.Л. Общая химия [Текст]: учеб. пособие для вузов / Н. Л. Глинка; под ред. А.И. Ермакова.- 30-е изд., испр.- М.: Интеграл-Пресс, 2004.- 727 с.
2 Глинка, Н.Л. Задачи и упражнения по общей химии [Текст]: учеб. пособие для нехим. специальностей вузов / Н. Л. Глинка; под ред. В.А. Рабиновича, Х.М. Рубиной.- Изд. испр.- М.: Интеграл-Пресс, 2004.- 240 с.
3 Ахметов, Н.С. Общая и неорганическая химия [Текст]: учеб. для вузов / Н.С. Ахметов.- 7-е изд., стер.- М.: Высш. шк., 2006.- 743 с.
4 Коровин Н.В. Курс общей химии. – М.: 2007. – 288 с.
|
|
|
|
|
Дата добавления: 2015-06-29; Просмотров: 8937; Нарушение авторских прав?; Мы поможем в написании вашей работы!