
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения типовых задач. Задача 1. Напишите уравнения реакций образования всех возможных кислых и основных солей: Fe(OH)3 + H3PO4 →
|
|
|
|
Задача 1. Напишите уравнения реакций образования всех возможных кислых и основных солей: Fe(OH)3 + H3PO4 →
Решение: Кислые или основные соли образуются при неполной нейтрализации многоосновной кислоты (кислые) или многокислотного основания (основные).
Трехосновная отрофосфорная кислота H3PO4 может образовать три вида солей: средняя соль - ортофосфаты, с кислотным основанием PO43-, и два вида кислых солей - дигидроортофосфаты - Н2PO4- и гидроортофосфаты- НPO42-.
Трехкислотное основание гидроксид железа (III) может образовать 4 вида солей: средняя соль – с катионом железа (III) Fe3+, и три вида основных солей – с катионом гидрокосжелеза (III) Fe(OH)2+ и дигидроксожелеза (III) Fe(OH)2+. Возможно и образование смешанной соли с катионами гидрокосжелеза (III) Fe(OH)2+ и дигидроксожелеза(III).
Таким образом, теоретически можно предсказать, что могут быть образованы 2 вида кислых солей и 3 вида основных.
Для образования кислых солей необходимо, чтобы основание было в избытке, то есть мольное отношение 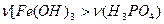 . То есть, возможны варианты
. То есть, возможны варианты 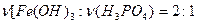 ,
, 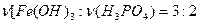 и
и 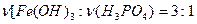 . В соответствие с этим напишем эти три уравнения.
. В соответствие с этим напишем эти три уравнения.
2Fe(OH)3 + H3PO4 → [ Fe(OH) 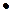 Fe(OH)2] PO4 + 3H2O
Fe(OH)2] PO4 + 3H2O
ортофосфатгидроксодигидроксожелеза (III)
3Fe(OH)3 + 2H3PO4 → [ Fe(OH)]3 (PO4)2 + 6H2O
ортофосфатгидроксожелеза (III)
3Fe(OH)3 + H3PO4 → [ Fe(OH)2]3 (PO4) + 3H2O
ортофосфатдигидроксожелеза (III)
Для образования кислых солей необходимо, чтобы в реакционной среде кислота была в избытке. То есть, возможны варианты 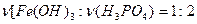 и
и 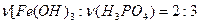 и
и 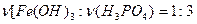 . В соответствие с этим напишем эти три уравнения.
. В соответствие с этим напишем эти три уравнения.
Fe(OH)3 + 2H3PO4 → Fe[HPO4  H2PO4] + 3H2O
H2PO4] + 3H2O
гидроортофосфатдигидроортофосфатжелеза (III)
2Fe(OH)3 + 3H3PO4 → Fe2 (НPO4)3 + 6H2O
ортофосфатгидроксожелеза (III)
Fe(OH)3 + 3H3PO4 → Fe (Н2PO4)3 + 6H2O
ортофосфатдигидроксожелеза (III)
Если студент затрудняется в определении структуры или брутто формулы образовавшейся соли, то можно прибегнуть к схематической формы решения задачи. Рассмотрим пример образования гидроортофосфатдигидроортофосфатжелеза (III) взаимодействием одной моли Fe(OH)3 и двух молей H3PO4.
 H – O
H – O

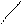 H – O – P=O H – O
H – O – P=O H – O


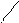
 O – H H – O O P=O
O – H H – O O P=O


 Fe – O – H + H – O → Fe – O + 3H2O
Fe – O – H + H – O → Fe – O + 3H2O

 O – H H – O – P=O О
O – H H – O – P=O О
 H – O H – O – P=O
H – O H – O – P=O
H – O
Задача 2. Имея в распоряжении только калий, воду, воздух и фосфор, получите максимальное число минеральных удобрений.
Решение.
2К + 2Н2О → 2КОН + Н2 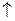
Воздух →N2 (78%) + О2 (21%)
N2 + 3Н2 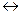 2NH3
2NH3 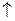
N2+ O2  2NO2
2NO2
2NO + O2→ 2NO2
4NO2 + O2+ 2H2O → 4HNO3
HNO3+ NH3→ NH4NO3 (нитрат аммония или аммиачная селитра)
4Р + 5О2 → 2Р2О5
Р2О5 + 3Н2О → 2Н3РО4
2Н3РО4 + 3NH3 → (NH4 )Н2РО4 + (NH4 )2НРО4 (аммофос)
Н3РО4 + 3КОН → 3Н2О +К3РО4 (ортофосфат калия)
КОН + HNO3→ КNO3 (нитрат калия или калийная селитра)
Задача 3. На примере ортофосфата гидроксокальция покажите химизм последовательного перехода основной соли в кислую (дигидроортофосфата кальция). Назовите все соли.
|
|
|
|
|
Дата добавления: 2015-06-29; Просмотров: 1845; Нарушение авторских прав?; Мы поможем в написании вашей работы!