
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Осмос. Осмотическое давление
|
|
|
|
Разбавленные растворы неэлектролитов и их свойства
При образовании растворов характер взаимодействия компонентов определяется их химической природой, что затрудняет выявление общих закономерностей. Поэтому удобно прибегнуть к некоторой идеализированной модели раствора, так называемому идеальному раствору. Раствор, образование которого не связано с изменением объема и тепловым эффектом, называют идеальным раствором. Однако, большинство растворов не обладает в полной мере свойствами идеальности и общие закономерности могут быть описаны на примерах так называемых разбавленных растворов, то есть растворов, в которых содержание растворенного вещества очень мало по сравнению с содержанием растворителя и взаимодействием молекул растворенного вещества с растворителем можно пренебречь. Растворы обладают к оллигативными свойствами — это свойства растворов, зависящие от числа частиц растворенного вещества. К коллигативным свойствам растворов относят:
· осмотическое давление;
· давление насыщенного пара. Закон Рауля;
· повышение температуры кипения;
· понижение температуры замерзания.
Пусть имеется сосуд, разделенный полупроницаемой перегородкой (пунктир на рисунке) на две части, заполненные до одинакового уровня О-О. В левой части помещается растворитель, в правой - раствор
|
|
|
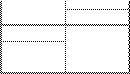
растворитель раствор
К понятию явления осмоса
Вследствие различия концентраций растворителя по обе стороны перегородки растворитель самопроизвольно (в соответствии с принципом Ле-Шателье) проникает через полупроницаемую перегородку в раствор, разбавляя его. Движущей силой преимущественной диффузии растворителя в раствор является разность свободных энергий чистого растворителя и растворителя в растворе. При разбавлении раствора за счет самопроизвольной диффузии растворителя объем раствора увеличивается и уровень перемещается из положения О в положение II. Односторонняя диффузия определенного сорта частиц в растворе через полупроницаемую перегородку называется осмосом.
Количественно охарактеризовать осмотические свойства раствора (по отношению к чистому растворителю) можно, введя понятие об осмотическом давлении. Последнее представляет собой меру стремления растворителя к переходу сквозь полупроницаемую перегородку в данный раствор. Оно равно тому дополнительному давлению, которое необходимо приложить к раствору, чтобы осмос прекратился (действие давления сводится к увеличению выхода молекул растворителя из раствора).
Растворы, характеризующиеся одинаковым осмотическим давлением, называются изотоническими. В биологии растворы с осмотическим давлением, большим, чем у внутриклеточного содержимого, называются гипертоническими, с меньшим – гипотоническими. Один и тот же раствор для одного типа клеток гипертонический, для другого – изотонический, для третьего – гипотонический.
Свойствами полупроницаемости обладает большинство тканей организмов. Поэтому осмотические явления имеют громадное значение для жизнедеятельности животных и растительных организмов. Процессы усвоения пищи, обмена веществ и т.д. тесно связаны с различной проницаемостью тканей для воды и тех или иных растворенных веществ. Явления осмоса объясняют некоторые вопросы, связанные с отношением организма к среде. Например, ими обусловлено то, что пресноводные рыбы не могут жить в морской воде, а морские в речной.
Вант-Гофф показал, что осмотическое давление в растворе неэлектролита пропорционально молярной концентрации растворенного вещества
Росм= сRТ,
где Росм - осмотическое давление, кПа; с - молярная концентрация, моль/дм3; R - газовая постоянная, равная 8,314 Дж/моль∙К; Т - температура, К.
Это выражение по форме аналогично уравнению Менделеева-Клапейрона для идеальных газов, однако эти уравнения описывают разные процессы. Осмотическое давление возникает в растворе при проникновении в него дополнительного количества растворителя через полупроницаемую перегородку. Это давление - сила, препятствующая дальнейшему выравниванию концентраций.
Вант-Гофф сформулировал закон осмотического давления: осмотическое давление равно тому давлению, которое производило бы растворенное вещество, если бы оно в виде идеального газа занимало тот же объем, который занимает раствор, при той же температуре.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 549; Нарушение авторских прав?; Мы поможем в написании вашей работы!