
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы электролитов и их свойства
|
|
|
|
В 1887 г. Вант-Гофф установил, что определенное экспериментально осмотическое давление в растворах электролитов превышает вычисленное практически. Подобные отклонения измеренных величин от вычисленных наблюдаются также для температуры кипения и замерзания растворов электролитов. Не зная, как можно объяснить эти отклонения, но стремясь приспособить уравнения, описывающие свойства растворов неэлектролитов, к растворам электролитов, Вант-Гофф ввел поправочный множитель i, названный изотоническим коэффициентом. Подставляя коэффициент i в уравнения для расчетов он получил соотношения, пригодные для описания свойств разбавленных растворов всех веществ, в том числе и для растворов электролитов
(Р0 - Р)/Р0 = iХА; Dt = iКст,; Росм = iсRТ
Коэффициент i, физический смысл которого Вант-Гофф не выяснил, зависит от природы раствора и его концентрации, но для одного и того же раствора значение i одинаково во всех трех приведенных уравнениях. Аррениус установил, что коэффициент i растет при разбавлении раствора.
Взаимодействие с растворителем растворенного вещества может вызвать распад последнего на ионы. Распад растворенного вещества на ионы под действием молекул растворителя называется электролитической диссоциацией или ионизацией веществ в растворах.
Возможность и степень распада растворенного вещества на ионы определяется природой растворенного вещества и растворителя. Электролитической диссоциации подвергаются ионные соединения и молекулярные соединения с полярным типом связи в полярных растворителях. Вода является сильнейшим полярным растворителем.
В зависимости от структуры растворяющегося вещества в безводном состоянии его диссоциация протекает по-разному. Наиболее типичны при этом два случая. Один из них – это диссоциация растворяющихся солей, то есть кристаллов с ионной структурой, второй - диссоциация при растворении кислот, то есть веществ состоящих из полярных молекул.
Когда кристалл соли, например хлорида калия, попадает в воду, то расположенные на его поверхности ионы притягивают к себе полярные молекулы воды (ион-дипольное взаимодействие). К ионам калия молекулы воды притягиваются своими отрицательными полюсами, а к хлорид-ионам – положительными.
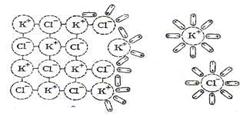 |
Схема растворения соли
Но если ионы притягивают к себе молекулы воды, то и последние с такой же силой притягивают к себе ионы. В то же время притянутые молекулы воды испытывают толчки со стороны других молекул, находящихся в движении. Этих толчков вместе с тепловыми колебаниями ионов в кристалле оказывается достаточно для отделения ионов от кристалла и перехода их в раствор. Вслед за первым слоем ионов в раствор переходит следующий слой, и таким образом идет постепенное растворение кристалла.
Иначе протекает диссоциация полярных молекул.
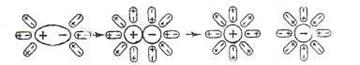 |
Схема диссоциации полярных молекул в растворе
Молекулы воды, притнувшиеся к концам полярной молекулы (диполь-дипольное взаимодействие), вызывают расхождение ее полюсов – поляризуют молекулу. Такая поляризация в сочетании с колебательным тепловым движением атомов в рассматриваемой молекуле, а также с непрерывным тепловым движением окружающих ее молекул воды, приводит, в конечном счете, к распаду полярной молекулы на ионы. Как и в случае растворенного ионного кристалла, эти ионы гидратируются. При этом ион водорода (Н+) (т.е. протон) оказывается прочно связанным с молекулой воды в ион гидроксония Н3О+. Так, при растворении в воде хлороводорода происходит процесс, который схематически можно выразить уравнением:
Н2О + НСl = H3O+ + Cl-
Диссоциацию молекул кислоты можно объяснить образованием дополнительной ковалентной связи (донорно-акцепторной). При этом общую связывающую электронную пару представляют не оба атома, а только один из них.
Диссоциации веществ как ионного, так и молекулярного строения способствует полярность молекул растворителя. Поэтому не только вода, но и другие жидкости, состоящие из полярных молекул (муравьиная кислота, этиловый спирт, аммиак и др.), также являются ионизирующими растворителями, а соли, кислоты и основания, растворенные в этих жидкостях, диссоциируют на ионы.
Вещества, распадающиеся в растворах или расплавах на положительно заряженные (катионы) и отрицательно заряженные (анионы) ионы, называются электролитами. Растворы электролитов способны проводить электрический ток. Электролитами являются кислоты, щелочи, большинство солей.
Отмеченные выше отклонения свойств растворов, определенных экспериментально, от вычисленных нельзя объяснить иным, кроме как увеличением числа частиц растворенного вещества, то есть диссоциацией молекул электролита в растворе на более мелкие частицы. Аррениус пришел к следующему выводу: диссоциация молекул растворенных электролитов на ионы происходит не под действием электрического тока, а уже в процессе растворения, независимо от того, пропускают через раствор электрический ток или нет (электролитическая диссоциация). В результате этого процесса в растворе увеличивается число частиц, поэтому коэффициент i принимает значения больше единицы.
Для количественной характеристики соотношения диссоциированных и недиссоциированных молекул электролита при данных условиях пользуются понятием степени электролитической диссоциации (a). Степень электролитической диссоциации a равна отношению числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества:
a = Nu/No
где Nu - число молекул распавшихся на ионы; No - общее число молекул растворенного вещества. Степень электролитической диссоциации зависит от:
1) природы растворенного вещества и растворителя;
2) температуры;
3) концентрации.
Роль растворителя в процессе электролитической диссоциации велика. Чем больше диэлектрическая проницаемость растворителя, тем больше его ионизирующее действие. Растворитель уменьшает силу взаимодействия частиц в полярной молекуле или силу взаимодействия ионов в кристалле. Она связана с i соотношением
a = (i-1)/(n-1).
По степени диссоциации электролиты разделяются на сильные, слабые и средние. Принято считать сильными электролитами те, для которых a > 30%, слабыми - если a < 3% и средние - если 3%< a < 30%. К сильным электролитам относятся почти все соли, многие неорганические кислоты (НNOз, Н2SО4, НС1О4, НС1, НВr, HI и др.) и гидроксиды щелочных (a = 90%) и щелочно - земельных металлов (a ≈ 60%). Электролитами средней силы являются некоторые органические и неорганические кислоты (Н2С2О4, НСООН, Н2SО3, Н3РO4 и др.), к слабым электролитам - кислоты Н2S, НСN, Н2SiOз, НзВОз, гидроксиды многих d-элементов (Сu(ОН)2, Сr(ОН)3 и др.), а также некоторые соли (НgС12, СdСl2, Fе(SСN)3) (a ≈ 2%).
Для описания реальных свойств растворов сильных электролитов, на которые значительное влияние оказывает электростатическое взаимодействие между ионами, усиливающееся с увеличением концентрации раствора, вводится понятие эффективной (кажущейся) концентрации, или активности а. Это понятие ввел Льюис в 1907 г. Активность (а) связана с истинной концентрацией растворенного вещества (с) соотношением:
a = f∙c, (1.12)
где f - коэффициент активности. Величина f рассматривается как кажущаяся степень диссоциации сильных электролитов. Она отражает все имеющие место в данной системе взаимодействия силовых полей. Чем слабее межионное взаимодействие в растворе, тем ближе значение f к единице. В сильно разбавленных растворах f = 1, а = с. Активность выражается в тех же единицах, что и концентрация, поскольку коэффициент активности -величина безразмерная.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 2588; Нарушение авторских прав?; Мы поможем в написании вашей работы!