
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электрохимическая коррозия. Виды электрохимической коррозии
|
|
|
|
Лекция 4.
Электрохимическая коррозия представляет собой самопроизвольное разрушение металлов в результате электрохимического взаимодействия с жидкими электролитами, обладающими электропроводностью. Такими электролитами могут быть вода, водные растворы кислот, щелочей, расплавленные соли. Электрохимическая коррозия широко распространена и имеет много разновидностей. Причина электрохимической коррозии-пониженная термодинамическая устойчивость большинства металлов и их стремление переходить в ионное состояние.
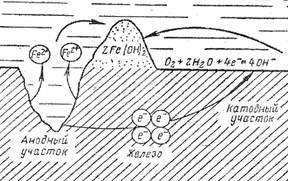
При электрохимической коррозии взаимодействие металла с окружающей средой характеризуется анодным и катодным процессами, протекающими на различных участках поверхности металла. Продукты коррозии образуются только на анодных участках.
Электрохимическая коррозия - результат работы коррозионных гальванических элементов. Она происходит следующим образом: на анодных участках протекает реакция окисления с образованием ионов металла Fe2+, а на катодных участках под влиянием кислорода образуется гидроокись (как результат протекания реакции кислородной деполяризации). Ионы Fe2+ и ОН- направляются друг к другу и образуют нерастворимый осадок Fe(OH)2, который может разлагаться на окись железа и воду. (Fe(OH)2—>Fe2О3+H2О). Высвобождающиеся при реакции окисления электроны от анодного участка по металлу изделия перетекают к катодному участку и участвуют в реакции восстановления.
Модель коррозионного микроэлемента представлена на рисунке 4.
 |
С электрохимическим механизмом протекают следующие виды коррозионных процессов:
Коррозия в электролитах – коррозия металлов в жидких средах, проводящих электрический ток. В зависимости от вида электролита различают коррозию в растворах кислот, щелочей и солей (кислотная, щелочная, солевая), в морской, речной воде.
Состав электролита определяет механизм процесса коррозии, влияет на его кинетику и скорость. Например скорость коррозии уменьшается, если электролит содержит анионы или окислители, в результате взаимодействия с которыми на поверхности металла образуется пленка труднорастворимых солей.
Растворенный в электролите кислород оказывает тормозящее или ускоряющее воздействие на процесс коррозии металлов.
На процесс коррозии влияет и концентрация электролита. Практически во всех природных средах с ростом концентрации солей в электролите скорость коррозии сначала возрастает до некоторого максимума, а затем уменьшается в результате снижения растворимости кислорода и затруднения катодного процесса.
Температура электролита также оказывает влияние на скорость коррозии. Это обусловлено тем, что с повышением температуры возрастает электропроводность электролита. С ростом температуры электролита скорость коррозии иногда может возрасти в десятки и сотни раз.
Почвенная коррозия – коррозия подземных металлических сооружений под воздействием почвенного электролита. На поверхности металлических изделий, находящихся в контакте с почвенным электролитом, вследствие местных неоднородностей металла или электролита возникает большое количество коррозионных элементов, природа которых аналогично природе гальванических элементов.
Почвенная коррозия является наиболее распространенным видом электрохимической коррозии, оказывающей воздействие на подземные металлические сооружения. Почвы и грунты чрезвычайно разнообразны не только в пределах больших регионов, но даже и в пределах одного небольшого участка. Между почвой, самым поверхностным слоем земли, и грунтом четкой границы нет.
Биокоррозия – частный случай почвенной коррозии, протекающая под воздействием микроорганизмов, в результате жизнедеятельности которых образуются вещества, ускоряющие коррозионные процессы. В природе наиболее широко распространены сульфатвосстанавливающие анаэробные бактерии, в результате действия которых образуется сероводород, который, соединяясь с железом, дает сернистое железо. Сульфатвосстанавливающие анаэробные бактерии, обычно обитают в воде, грязи, сточных водах, нефтяных скважинах, донных осадках, почве, цементе. Наиболее благоприятной средой для развития этих бактерий являются почвы с 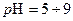 (оптимально 6-7,5) при 25-300С. Жизнедеятельность железных аэробных бактерий сопровождается выделением в качестве продуктов коррозии нерастворимой пленки гидроокиси железа.
(оптимально 6-7,5) при 25-300С. Жизнедеятельность железных аэробных бактерий сопровождается выделением в качестве продуктов коррозии нерастворимой пленки гидроокиси железа.
Биокоррозия (обрастание подводных сооружений морскими растительными и животными организмами — мшанками, балянусами, диатомеями, кораллами) разрушает защитные покрытия и ускоряет разрушение металлов. Некоторые живые организмы (например, мидии) замедляют коррозионный процесс, так как потребляют много кислорода.
Атмосферная коррозия – коррозия металлов в атмосфере воздуха или в среде любого влажного газа. При отсутствии влаги в воздухе железо корродирует с незначительной скоростью.
Она зависит от степени увлажненности поверхности металлов и по этому признаку подразделяется на три типа:
1) мокрая атмосферная коррозия (при относительной влажности воздуха ~ 100 %) при наличии видимой пленки влаги на поверхности металла;
2) влажная атмосферная коррозия при наличии на поверхности металла невидимой пленки влаги, которая образуется при капиллярной адсорбционной или химической конденсации;
3) сухая атмосферная коррозия при полном отсутствии влаги на поверхности металла.
Атмосферы существенно различаются по влажности, температуре и загрязнению, поэтому скорость атмосферной коррозии в различных районах неодинакова, чем ближе к морскому побережью, тем больше воздух насыщен морской солью, в особенности NaCl. В промышленных областях в воздухе появляются значительные количества SO2, который превращается в серную кислоту. При работе двигателей внутреннего сгорания в большом количестве образуется NO, который выделяется в атмосферу. В городах и индустриальных центрах в атмосферу выделяется большое количество H2S.
По агрессивности атмосферы можно разделить на следующие основные типы: морскую, промышленную, городскую, сельскую, арктическую.
Специфическими факторами, влияющими, на агрессивность атмосферы являются (кроме газов) пыль и влага.
Пленки ржавчины, образующиеся в атмосферных условиях, могут иметь защитные свойства, поэтому скорость коррозии со временем снижается.
В реальных условиях все эти типы коррозии взаимно переходят друг в друга. Характер изменения скорости атмосферной коррозии в зависимости от толщины пленки влаги показан на рисунке. Эта скорость изменяется от нуля для сухой атмосферной коррозии, достигает максимума для влажной атмосферной коррозии и снижается до некоторого постоянного значения, характеризующего скорость коррозии данного металла в электролите.
На скорость атмосферной коррозии металлов влияет большое число факторов:
1) влажность воздуха (создание электролита);
2) примеси воздуха (газы SO2, SO3, K2S, NH3, СЬ- НС1 и др. в контакте с водой действуют как депассиваторы, комплексообразователи или катодные деполяризаторы; твердые частицы увеличивают электропроводность пленки электролита и облегчают адсорбцию газов и влаги из воздуха);
3) характер атмосферы (чистая, грязная, сухая, влажная);
4) географическая зона (тропики, субтропики, средняя полоса, пустым, полюс);
5) состояние поверхности корродирующего материала (наличие продуктов коррозии);
6) наличие инородных включений в металле (одни из них защищают от коррозии - катодные включения, например Си, Pb, Pd, а другие способствуют разрушению металла);
7) температура (с повышением температуры скорость коррозии влажность снижаются).
Методы защиты металлов от атмосферной коррозии сводятся следующему:
а) нанесению защитных покрытий (смазки, лаки, пленки, цинкование, никелирование, хромирование, фосфотирование, окисные пленки); б) воздействию на контролирующие процессы (пассивация анода Сг, Al, Ti, Ni, катодные включения Си, Pd); в) уменьшению слоя электролита на поверхности корродирующего металла (осушка и очистка воздуха); г) применению замедлителей коррозии (NaNО2, нитриты, карбонаты, бензоаты дициклогексиламина и моноэтаноламина) в основном при хранении металлов и транспортировании их в контейнерах или упаковке из оберточных материалов.
Электрокоррозия – коррозия подземных металлических сооружений, вызванная проникновением на сооружения токов утечки с рельсов электрифицированного транспорта или других промышленных электроустановок и сооружений (электрифицированные железные дороги, метрополитены, линии передачи постоянного тока, установки катодной защиты подземных металлических сооружений).
Эти токи получили название блуждающих, величина и направление их могут изменяться во времени.
Основной величиной, характеризующей интенсивность процесса электрокоррозии, являются сила тока, стекающего с подземного сооружения в грунт, отнесенная к единице поверхности.
Величина тока утечки с подземного сооружения зависит от многих факторов, в частности:
- удельное сопротивление земли;
- величина блуждающих токов в земле;
- взаимное расположение источников блуждающих токов и подземного сооружения;
- состояние внешнего изолирующего покрытия на подземном сооружении;
- продольное сопротивление подземного сооружения.
Контактная коррозия – коррозия, вызванная электрическим контактом двух металлов имеющих различный электрохимический потенциал.
Коррозия под напряжением возникает при одновременном воздействий коррозионной среды и механических напряжений в металле.
Щелевая коррозия – ускорение коррозионного разрушения металла электролитом в узких зазорах и щелях (в резьбовых и фланцевых соединениях).
Коррозионная эрозия – при одновременном воздействии коррозионной среды и трения.
Коррозионная кавитация возникает при одновременном коррозионным и ударном воздействии окружающей среды (коррозия лопаток рабочих колес центробежных насосов, разрушение лопаток гребных винтов на судах).
Фреттинг – коррозия представляет собой локальное коррозионное разрушение металлов при воздействии агрессивной среды в условиях колебательного перемещения двух трущихся поверхностей относительно друг друга.
Структурная коррозия обусловлена структурной неоднородностью сплава. При этом происходит ускоренный процесс коррозионного разрушения вследствие повышенной активности какого–либо компонента сплава.
Термоконтактная коррозия возникает за счет температурного градиента, обусловленна неравномерным нагреванием поверхности металла.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 5103; Нарушение авторских прав?; Мы поможем в написании вашей работы!