
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение состояния идеальных газов
|
|
|
|
Тема № 2
Основные законы идеальных газов
Идеализация основных свойств тела, находящегося в газообразном состоянии – незначительности сил взаимного притяжения молекул и малости их объема, приводит к представлению об идеальном газе, у которого силы взаимного притяжения молекул вообще отсутствуют, а сами молекулы не имеют объема, т.е. представляют собой материальные точки.
Эти предпосылки позволяют получить теоретически выражение, называемое основным уравнением кинетической теории газов, или уравнение Клаузиуса:
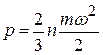 , (2.1)
, (2.1)
где р – давление газа;
n – число молекул;
m – масса молекул;
w – средняя скорость молекул.
Из этого уравнения с учетом зависимости (1.3) получаем:
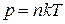 .
.
Обозначив число молекул в одном килограмме газа через z, имеем:
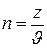
и тогда 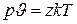 .
.
Написав это уравнение для двух произвольных состояний газа:
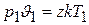 и
и 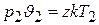
и разделив первое равенство на второе, а затем, объединив параметры, относящиеся к одному и тому же состоянию, находим:
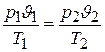 . (2.2)
. (2.2)
Поскольку состояния газа были приняты произвольно, очевидно, что величина
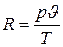
имеет одно и то же значение для любого состояния газа. Она называется газовой постоянной и имеет размерность
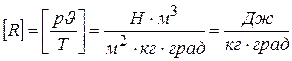 .
.
Таким образом, термические параметры идеального газа в любом его состоянии связаны зависимостью
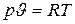 , (2.3)
, (2.3)
которая представляет собой термическое уравнение состояния идеального газа.
Впервые эта зависимость была получена Клапейроном и поэтому часто называется уравнением Клапейрона.
Умножая обе части равенства на массу газа М и учитывая, что 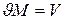 , где V – полный объем этого газа, получаем уравнение состояния произвольного количества идеального газа:
, где V – полный объем этого газа, получаем уравнение состояния произвольного количества идеального газа:
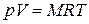 . (2.4)
. (2.4)
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 387; Нарушение авторских прав?; Мы поможем в написании вашей работы!