
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные законы идеальных газов
|
|
|
|
Полагая 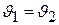 , из уравнения (2.2) получаем, что
, из уравнения (2.2) получаем, что
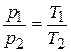 , (2.5)
, (2.5)
т.е. при постоянном объеме давление газа изменяется прямо пропорционально его абсолютной температуре. Это положение называется законом Шарля.
Полагая в этом же уравнении (2.2), что 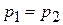 , получаем:
, получаем:
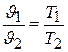 , (2.6)
, (2.6)
т.е. при постоянном давлении объем газа изменяется прямо пропорционально его абсолютной температуре. Это положение называется законом Гей –Люссака.
Наконец, полагая в уравнении (2.2), что 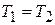 , получаем:
, получаем:
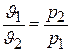 , (2.7)
, (2.7)
т.е. при постоянной температуре объем газа изменяется обратно пропорционально давлению. Это положение называется законом Бойля – Мариотта.
Из формулы (1.3) видно, что если разные газы, молекулы которых имеют равную массу, имеют одинаковую температуру, то средние кинетические энергии молекул их равны. Если же у этих газов одинаковы и давления, то у них равны и количества молекул в единице объема, поскольку
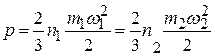 ,
,
а после сокращения 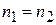 .
.
Отсюда следует, что разные газы, находящиеся при одинаковых давлениях и температурах занимающие одинаковые объемы, содержат одинаковое число молекул. Это положение называется законом Авогадро.
Из закона Авогадро вытекает, что при одинаковых давлениях и температурах плотности газов пропорциональны их молекулярным массам, т.е.
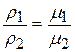 , (2.8)
, (2.8)
где m – молекулярная масса газа.
Однако плотность газа и удельный объем его – величины взаимно обратные, т.е.
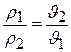 ,
,
следовательно,
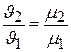 и
и 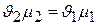
и вообще 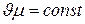 . (2.9)
. (2.9)
Произведение 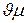 является объемом киломоля, т.е. такого количества газа, масса которого, выраженная в килограммах, численно равна его молекулярной массе.
является объемом киломоля, т.е. такого количества газа, масса которого, выраженная в килограммах, численно равна его молекулярной массе.
Киломоль часто используется в качестве единицы измерения количества газа, что удобно, поскольку, как видно из формулы (2.9), объемы киломолей всех газов при одинаковых давлениях и температурах равны между собой. В частности, при нормальных условиях (р0= 760 мм.рт.ст =
=10133 Н/м2 и t0= 00C) объем киломоля любого газа равен 22,4 м3.
Естественно, что сказанное в полной мере относится к лишь идеальным газам.
Согласно определению, масса одного киломоля газа равна m кг. Поэтому удельный объем и плотность любого идеального газа при нормальных условиях могут быть определены по простым формулам:
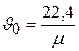 , м3/кг (2.10)
, м3/кг (2.10)
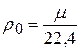 кг/м3 . (2.11)
кг/м3 . (2.11)
Обозначив объем киломоля в произвольном состоянии газа через 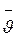 и учитывая, что масса его постоянна и в любом состоянии равна m кг/кмоль, получаем уравнение состояния для одного киломоля идеального газа, выведенное Д.И. Менделеевым:
и учитывая, что масса его постоянна и в любом состоянии равна m кг/кмоль, получаем уравнение состояния для одного киломоля идеального газа, выведенное Д.И. Менделеевым:
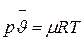 .
.
Величина 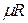 представляет собой газовую постоянную одного киломоля. Обозначив ее через
представляет собой газовую постоянную одного киломоля. Обозначив ее через 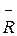 , имеем:
, имеем:
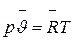 . (2.12)
. (2.12)
Отсюда видно, что величина 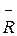 не зависти от природы газа, т.е. для всех газов имеет одинаковое значение. Поэтому она называется универсальной газовой постоянной. Вычислить ее можно из уравнения состояния для одного киломоля, написанного для нормальных условий:
не зависти от природы газа, т.е. для всех газов имеет одинаковое значение. Поэтому она называется универсальной газовой постоянной. Вычислить ее можно из уравнения состояния для одного киломоля, написанного для нормальных условий:
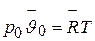 ,
,
откуда
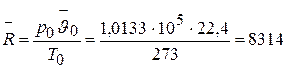 Дж/(кмоль× град).
Дж/(кмоль× град).
В связи с этим газовая постоянная 1 кг любого газа может быть определена по простой формуле
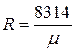 , Дж/(кг × град). (2.13)
, Дж/(кг × град). (2.13)
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 375; Нарушение авторских прав?; Мы поможем в написании вашей работы!