
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Скорость химической реакции
|
|
|
|
Скорость реакции измеряют по изменению концентраций участвующих в ней веществ за определенный промежуток времени. Скоростью химической реакции называют изменение количества реагирующего вещества за единицу времени в единице реакционного пространства:
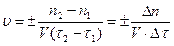 ,
,
где n1 – число молей участника реакции в момент времени t1, n2 – число молей того же вещества в момент времени t2, а t1, t2 – начальный и конечный момент времени реакции.
Отношение количества вещества к единице объема – это не что иное, как молярная концентрация вещества С(В). Различают среднюю скорость реакции (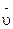 ) и истинную скорость (υ), т.е. скорость в данный момент времени.
) и истинную скорость (υ), т.е. скорость в данный момент времени.
Средняя скорость реакции 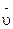 равна отношению изменения концентрации реагирующего вещества Δc(В) к промежутку времени, в течение которого оно произошло:
равна отношению изменения концентрации реагирующего вещества Δc(В) к промежутку времени, в течение которого оно произошло:
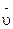 =
= 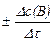 =
= 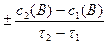 , [моль/л∙с], (1)
, [моль/л∙с], (1)
где c1(В), c2(В) – молярная концентрация вещества в момент времени t1 и t2, соответственно.
Скорость гомогенной реакции равна изменению концентрации какого-либо из участников реакции (реагента или продукта) в единицу времени.
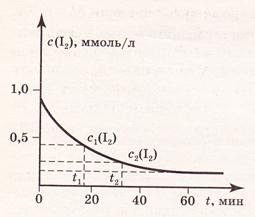
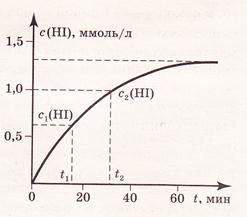
Изменение концентрации реагентов продуктов реакции во времени изображают графически (рис. 1 и 2). В начальный момент времени (t=0) концентрация реагентов наибольшая, а концентрация продуктов обычно равна нулю. В процессе реакции концентрация реагентов уменьшается, а концентрация продуктов растет. Рассмотрим на рис. 1 и 2 для реакции H2(г) + I2(г) = 2HI(г)
| 
|
| Рис. 1. Изменение концентрации реагента C(I2) в зависимости от времени t реакции. | Рис.2. Изменение концентрации продукта реакции C(НI) в зависимости от времени t реакции. |
Для гомогенной реакции A + B ® D (все стехиометрические коэффициенты равны единице):
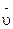 =
= 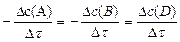
Для гомогенной реакции 2A ® 3D (нужно учесть стехиометрические коэффициенты 2 и 3):
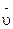 =
= 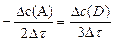
В процессе реакции при постоянных внешних условиях скорость меняется из-за расходования реагентов. И для определения кинетических закономерностей используют не среднюю, а мгновенную скорость реакции.
Скорость реакции мгновенная или истинная (υ) равна изменению концентрации вещества за бесконечно малый промежуток времени:
υ = ± 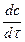 , [моль/л∙с, моль/л∙мин], (2)
, [моль/л∙с, моль/л∙мин], (2)
Поскольку скорость реакции должна быть величиной положительной, то в формулах (1) и (2) при увеличении концентрации вещества в ходе реакции (продукты реакции) ставят пред дробью знак «+», а при уменьшении концентрации вещества (исходные вещества) - знак «–», так как скорость реакции должна быть величиной положительной.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 6092; Нарушение авторских прав?; Мы поможем в написании вашей работы!