
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние концентраций веществ на скорость химической реакции
|
|
|
|
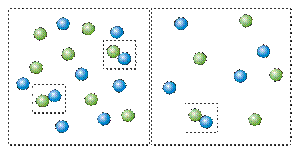
Чтобы вещества прореагировали, необходимо, чтобы их молекулы столкнулись. Вероятность столкновения двух людей на оживленной улице гораздо выше, чем на пустынной. Так и с молекулами. Очевидно, что вероятность столкновения молекул на рисунке слева выше, чем справа. Она прямо пропорциональна количеству молекул реагентов в единице объема, т.е. молярным концентрациям реагентов. Это можно продемонстрировать с помощью картинки:
В середине XIX в. (1865 г. - Н.Н.Бекетов, 1867 г. - К.Гульдберг, П.Вааге) был сформулирован основной постулат химической кинетики, называемый также законом действующих масс.
Зависимость скорости реакции от концентрации реагирующих веществ определяется законом действующих масс (з.д.м.): при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Закон действующих масс справедлив только для простых реакций, т.е. для реакций, протекающих в одну стадию. Поскольку число простых реакций невелико, то примем, что з.д.м. формально может быть применим ко всем рассматриваемым реакциям.
В гомогенной системе реакционным пространством служит объем сосуда, в котором протекает взаимодействие.
В общем случае для гомогенной реакции
νAА + νBВ = νDD + νFF
скорость прямой реакции зависит от концентрации исходных веществ:
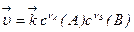 , (3)
, (3)
а скорость обратной реакции – от концентрации продуктов реакции:
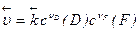 , (4)
, (4)
где 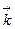 и
и 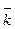 - константы скорости прямой и обратной реакции, соответственно, c(A), c(В), c(D) и c(F) – молярные концентрации соответствующих веществ, моль/л.
- константы скорости прямой и обратной реакции, соответственно, c(A), c(В), c(D) и c(F) – молярные концентрации соответствующих веществ, моль/л.
Физический смысл константы скорости реакции – это скорость реакции при концентрациях реагирующих веществ, равных единице (1 моль/л). Константа скорости реакции зависит от природы веществ и от температуры и не зависит от концентрации реагирующих веществ. Поэтому константа скорости остается неизменной в ходе реакции.
Например:
2СО(г) + О2(г) = 2СО2(г) (5)
скорость прямой реакции 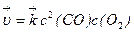 (6)
(6)
cкорость обратной реакции 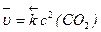 (7)
(7)
Вгетерогенной системе реакция осуществляется на поверхности раздела фаз. Поверхность раздела фаз является в этом случае реакционным пространством. Концентрация компонента, находящегося в конденсированной фазе, постоянна. Значение этой постоянной включается в величину k и не учитывается в законе действующих масс.
Например, для гетерогенной реакции
2Zn(кр) +O2(г) = 2ZnO(кр) (8)
скорость прямой реакции – 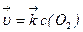 ; (9)
; (9)
а скорость обратной реакции – 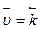 . (10)
. (10)
Сама зависимость скорости реакции от концентрации реагентов носит название кинетического уравнения реакции, показатели степени при концентрациях реагентов называются порядком реакции по этому реагенту, а их сумма – общий порядок реакции.
Например, процессу синтеза йодоводорода из простых веществ H2(г) + I2(г) = 2HI(г)
отвечает кинетическое уравнение 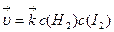 . Реакция имеет первые порядки по водороду и йоду и общий второй порядок.
. Реакция имеет первые порядки по водороду и йоду и общий второй порядок.
Но порядки реакции не следует отождествлять со стехиометрическими коэффициентами. Эти понятия имеют совершенно разный физический смысл. Порядок реакции – это экспериментальная величина, существенно зависящая от механизма процесса, а стехиометрический коэффициент показывает соотношение числа молей участников реакции в итоговом уравнении реакции.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1309; Нарушение авторских прав?; Мы поможем в написании вашей работы!