
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Предмет и основные понятия химической термодинамики
|
|
|
|



- внутренняя энергия U–полная энергия частиц, составляющих данное вещество; она слагается из кинетической энергии поступательного, колебательного и вращательного движения частиц, а также потенциальной энергии сил притяжения и отталкивания, действующих между частицами.
- энтальпия системы Н –термодинамическая функция, характеризующая систему, находящуюся при постоянном давлении; Н=U+pV, где p и V – соответственно, давление и объем системы;
- энтропия S и ее изменение DS, являющиеся мерой структурной неупорядоченности системы, Дж/(моль×К);
- свободная энергия Гельмгольца (F) и ее изменение D F, которые являются мерой химического сродства и критерием самопроизвольного протекания изохорно-изотермических процессов, кДж/моль;
- свободная энергия Гиббса G и ее изменение DG, которые являются мерой химического сродства и критерием самопроизвольного протекания изобарно-изотермических процессов, кДж/моль.

2.Первый закон термодинамики Основным законом термодинамики и одним из важнейших законов природы является первое начало термодинамики. Этот закон был установлен в результате работ Майера (1842г) и Джоуля (1843г). Первым началом термодинамики этот закон назвал Р. Клаузиус. Первое начало термодинамики в замкнутой системе энергия не возникает и не исчезает, при переходе одних форм энергии в другие сумма их остаётся неизменной. Согласно первому началу термодинамики, количество энергии, которое поглощается или выделяется в форме теплоты Q и работы A, постоянно для данного процесса, т.к. энергия не может исчезать или возникать, и следовательно, количество подведённой теплотыи совершённой работы равно изменению внутренней энергии: Q + A = ΔU. Работа, как правило, совершается против внешних сил A = -P (V2- V1)= -PΔV. Подвод теплоты к системе может осуществляться при двух процессах: изохорном и изобарном.
Изохорный процесс:
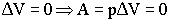
Вывод: при изохорном процессе подведённая теплота полностью расходуется на изменение внутренней энергии системы: Q V = ΔU.
Изобарный процесс:
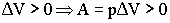
ΔU= Q p + A = Q- pΔ V;
Q p = ΔU – A = ΔU + pΔ V
Q p = U 2 -U 1 + p(V 2 – V 1) = (U 2 + pV 2) – (U 1 + pV 1).
Функция U + pV = H – называется энтальпией.
Итак, U 2 + pV 2 и U 1 + pV 1 – величины энтальпий для состояний 2 и 1 системы, соответственно:
U 2 + pV 2 = H 2;
U 1 + pV 1 = H 1.
Тогда Q p = H 2 – H 1 = ΔH.
Теплота, подведённая к системе при постоянном давлении, равняется изменению энтальпии данной системы. Изменение энтальпии – теплота, выделившаяся при изобарном процессе. Поскольку энтальпия выводится из внутренней энергии, она также является функцией состояния. Измеряется и рассчитывается не сама энтальпия, а её изменение, приведённое к нормальным условиям: ΔH 0298 кДж/моль. Образование веществ может происходить как с поглощением, так и с выделением энергии. Если величина Q p положительна, то реакция эндотермическая, т.е. энтальпия продуктов реакции выше энтальпии исходных веществ. Если величина Q p отрицательна, то реакция экзотермическая: энтальпия продуктов реакции ниже энтальпии исходных веществ. Вещество тем прочнее, чем больше энергии выделяется при его образовании.
3.Закон Гесса. Изменение энтальпии химической реакции, то - есть и тепловой эффект, подчиняется закону Гесса (1840г). Тепловой эффект химической реакции зависит только от начального и конечного состояния химической реакции, то - есть зависит от вида и состояния исходных веществ и продуктов реакции.
Следствие закона Гесса: Изменение энтальпии химической реакции равно сумме изменений энтальпий продуктов реакции за вычетом суммы изменения энтальпий исходных веществ.
aA + bB = cC + dD
ΔH 0х.р. = (cΔH 0C + dΔH 0D) – (aΔH 0A + bΔH 0B) кДж.
Тепловой эффект реакции образования одного моля вещества из простых веществ называется теплотой образования DН данного вещества. Энтальпию образования 1 моль сложного вещества из простых веществ, измеренную при температуре 298К и давлении 101,325 кПа, называют стандартной энтальпией образования 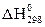 , кДж/моль. Энтальпии простых веществ (О2, Н2, S и т.п.) условно принимают равными нулю.
, кДж/моль. Энтальпии простых веществ (О2, Н2, S и т.п.) условно принимают равными нулю.
Термохимические расчеты осуществляют, применяя следствие из закона Гесса:
Пример1. Вычислить тепловой эффект, написать термохимическое уравнение горения 1 моль метана и рассчитать количество теплоты, которое выделится при сгорании 10 л CH4.
Решение. Составим термохимическое уравнение реакции
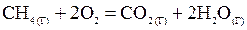 .
.
Выпишем стандартные теплоты образования 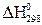 веществ (табл. 2 прил.2):
веществ (табл. 2 прил.2):
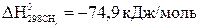 ;
;
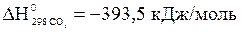 ;
;
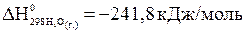 .
.
Тепловой эффект реакции вычислим, используя следствие закона Гесса:
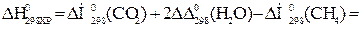
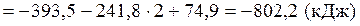
При сжигании 22,4 л выделяется 802,2 кДж, при сжигании 10л выделяется х кДж. Составим и решим пропорцию:
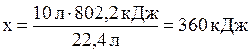 .
.
Ответ: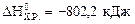 , при сжигании 10 л метана выделяется 360 кДж.
, при сжигании 10 л метана выделяется 360 кДж.
7.4.Упражнения для самоконтроля направлены на закрепление следующих понятий:
1. Определение молярной теплоты образования соединения.
2. Определение теплового эффекта реакции.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 407; Нарушение авторских прав?; Мы поможем в написании вашей работы!