
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Упражнения
|
|
|
|
1.Рассчитайте при температуре 25о С стандартное изменение свободной энергии Гиббса образования оксида Fе2О3 из соответствующих простых веществ, если известны стандартная энтальпии образования (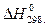 ,кДж/моль) и стандартные энтропия образования(Δ
,кДж/моль) и стандартные энтропия образования(Δ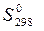 ,Дж/моль·К) данного оксида. Может ли данная реакция протекать самопроизвольно?
,Дж/моль·К) данного оксида. Может ли данная реакция протекать самопроизвольно?
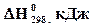 = -824
= -824
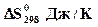 ,ДЖ/мольК= 78
,ДЖ/мольК= 78
2. По приведенным стандартным значениям изменения энтальпии и энтропии для химической реакции рассчитайте температуру, при которой равновероятны прямое и обратное направления данной реакции. В каком направлении, прямом или обратном, данная реакция будет протекать самопроизвольно при более высоких температурах?
| Реакция | 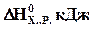
| 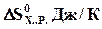
|
| СО2(г)+С(г)=2СО(г) | + 173 | +176; |
Ответы:1-; 2-
Лекция 9. Химическая кинетика: Скорость реакции, химическое равновесие..
Понятие скорости реакции. Зависимость скорости реакции от концентрации реагентов. Зависимость скорости реакции от температуры. Химическое равновесие. Принцип Ле Шателье Фазовое равновесие. Правило фаз.
9.1.Понятие скорости реакци Раздел химии, изучающий скорости и механизмы протекания реакций, называется химической кинетикой. Под скоростью химической реакции понимается изменение количества вещества за какой-то промежуток времени:
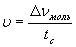 .
.
Различают скорость реакции в гомогенных (однородных) и гетерогенных (неоднородных) системах. В гомогенных системах реакции протекают по всему объему:
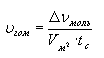 .
.
В гетерогенных системах реакции протекают на границе фаз, поэтому изменение количества вещества относят к площади раздела фаз:
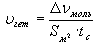 .
.
Скорость реакции зависит от следующих факторов: природа реагирующих веществ; концентрация реагирующих веществ; газовое давление; температура, катализатор.
9.2.Зависимость скорости реакции от концентрации реагирующих веществ подчиняется закону действия масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, каждая из которых взята в степени, равной соответствующему стехиометрическому коэффициенту в уравнении реакции (Гульдберг, Ваге).
Запишем химическую реакцию в общем виде: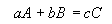 .
.
Если считать, что реакция протекает в гомогенной среде, то закон действия масс для неё выглядит следующим образом:
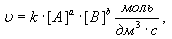 ,
,
где [А] и [В] – молярные концентрации веществ А и В;
а и в – показатели степеней, соответствующие количеству моль веществ А и В;
к – константа скорости реакции, зависящая от температуры, но не зависящая от концентрации реагирующих веществ. Уравнение для скорости реакции называется кинетическим уравнением химической реакции. Рассмотрим закон действия масс для конкретных реакций:
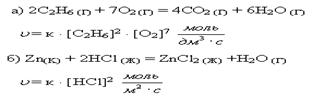 .
.
Цинк – твердое вещество, его участие в реакции учитывается константой скорости химической реакции.
9.3. Зависимость скорости гомогенной реакции от температуры. Влияние температуры на скорость химической реакции подчиняется правилу Вант-Гоффа: При изменении температуры на 10oС, скорость реакции изменяется в 2÷4 раза.
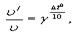 где ν - начальная скорость реакции;
где ν - начальная скорость реакции;
ν'-измененная скорость;
γ- температурный коэффициент;
Δt0- изменение температуры реакции. Зависимость константы скорости реакции от температуры также подчиняется уравнению Вант-Гоффа: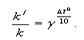
Пример решения задачи При 20oС скорость реакции составляет 0,5. Чему равна скорость той же реакции при 70oС, если температурный коэффициент равен 2?
Решение: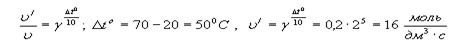 .
.
9.3. Химическое равновесие характерно для обратимых реакций.. Обратимыми называются реакции, в которых ни одно из исходных веществ до конца не расходуется. Обратимые реакции с определенного момента протекают в обоих направлениях – прямом и обратном:
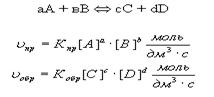 .
.
В обратимых реакциях устанавливается состояние равновесия, которое выражается в равенстве скоростей прямой и обратной реакций: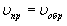 Состояние равновесия характеризуется константой равновесия (Кр):
Состояние равновесия характеризуется константой равновесия (Кр):
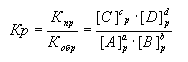 .
.
Индекс "р" означает равновесные концентрации веществ. Состояние равновесия устойчиво и может сохраняться как угодно долго, пока на систему не будет оказано какое-либо внешнее воздействие: изменение концентрации реагирующих веществ; изменение газового давления; изменение температуры. Нарушение состояния равновесия обратимой реакции означает, что скорости прямой и обратной реакций не равны друг другу. В зависимости от этого, равновесие обратимой реакции смещается либо в прямом  , либо в обратном
, либо в обратном  направлении. Направление смещения обратимой реакции подчиняется принципу Ле Шателье: "Если на систему, находящуюся в равновесии, оказать какое-либо внешнее воздействие, то равновесие сместится в таком направлении, чтобы ослабить оказанное воздействие".
направлении. Направление смещения обратимой реакции подчиняется принципу Ле Шателье: "Если на систему, находящуюся в равновесии, оказать какое-либо внешнее воздействие, то равновесие сместится в таком направлении, чтобы ослабить оказанное воздействие".
9.5. Фазовое равновесие. Правило фаз.
Равновесие перехода из одной фазы в другую без изменения химического состава называется фазовым равновесием. Примеры: переходы твердое вещество-жидкость-пар. Фазовое равновесие является динамическим равновесием,т.е. скорость прямого процесса равна скорости обратного процесса. Условием равновесия является ΔG=0.Для фазового равновесия соблюдается закон Ле-Шателье. К наиболее общим законам фазового равновесия относится правило фаз Гиббса.: Число степеней свободы С, фаз Ф, независимых компонентов К и внешних условий П, влияющих на равновесие, взаимосвязаны соотношением: С=К-Ф+П Под компонентами системы принято понимать химические вещества, которые могут существовать в изолированном виде и определять состав системы. Независимые компоненты – те, наименьшее число которых достаточно для образования всех фаз системы. Число степеней свободы – вариабельность системы; число независимых друг от друга факторов равновесия (число факторов, которые можно менять произвольно, не нарушая состояния системы) На фазовое равновесие обычно влияют температура и давление, П = 2, т.е. С=К-Ф+2. Для однокомпонентных систем правило фаз имеет вид: С=3-Ф=2, т.е. однофазная система имеет две степени свободы, двухфазная система имеет одну степень свободы, трехфазная система не имеет степеней свободы.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 420; Нарушение авторских прав?; Мы поможем в написании вашей работы!