
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теплоемкость идеального газа. Уравнение состояния идеального газа
|
|
|
|
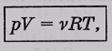 Уравнение состояния идеального газа. Идеальным называют газ, уравнение состояния которого имеет вид
Уравнение состояния идеального газа. Идеальным называют газ, уравнение состояния которого имеет вид
его называют уравнением Клапейрона. Здесь 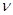 — количество вещества, измеряемое числом молей, R-универсальная газовая постоянная равная: 8,314 Дж/(моль-К).
— количество вещества, измеряемое числом молей, R-универсальная газовая постоянная равная: 8,314 Дж/(моль-К).
 Моль — это количество вещества, содержащее число частиц, равное постоянной Авогадро:
Моль — это количество вещества, содержащее число частиц, равное постоянной Авогадро:
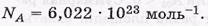
Молю соответствует масса — молярная масса, — разная для различных газов. Эти массы приведены в периодической системе элементов, где у каждого элемента первое число — порядковый номер, а второе — молярная масса в г/моль.
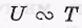 Теплоемкость идеального газа. Внутренняя энергия U идеального газа зависит только от температуры Т, причем
Теплоемкость идеального газа. Внутренняя энергия U идеального газа зависит только от температуры Т, причем
в довольно широком диапазоне температур. Коэффициент пропорциональности зависит от рода газа.
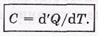 Теплоемкостью С тела (газа) называют количество тепла, которое нужно сообщить телу, чтобы повысить его температуру на один кельвин:
Теплоемкостью С тела (газа) называют количество тепла, которое нужно сообщить телу, чтобы повысить его температуру на один кельвин:
Теплоемкость С является функцией процесса.
Мы будем пользоваться в основном молярной теплоемкостью С, Дж/моль۰К). В таблицах обычно указывают удельную теплоемкость
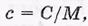
где с, Дж/(кг • К), М — молярная масса.
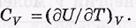 Особое значение имеют теплоемкости для двух процессов: при постоянном объеме C v и при постоянном давлении Ср. При постоянном объеме dV = 0, и поэтому имеем
Особое значение имеют теплоемкости для двух процессов: при постоянном объеме C v и при постоянном давлении Ср. При постоянном объеме dV = 0, и поэтому имеем
Такая форма записи подчеркивает, что при дифференцировании U по Т объем V следует считать постоянным (это так называемая частная производная).
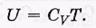 Опыт показывает, что во многих случаях теплоемкость С в широком интервале температур почти не меняется. Если считать, что С совсем не зависит от Т,то dU = Сv dT, и можно написать простую формулу
Опыт показывает, что во многих случаях теплоемкость С в широком интервале температур почти не меняется. Если считать, что С совсем не зависит от Т,то dU = Сv dT, и можно написать простую формулу
Представим выражение для теплоемкости, в виде
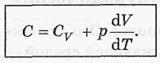
Если процесс изобарический (р = const), то из уравнения состояния следует, что p(dV/dT) =R, и соответствующая молярная теплоемкость
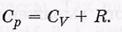
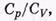 Важной характеристикой газов является отношение которое обозначают буквой
Важной характеристикой газов является отношение которое обозначают буквой 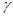 и называют постоянной адиабаты.
и называют постоянной адиабаты.
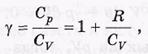
откуда молярная теплоемкость
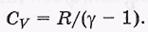
Из опыта следует, что значения у для разных газов лежат в пределах 1,3 ÷ 1,67.
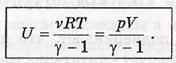 Другие формы выражения для внутренней энергии v молей идеального газа:
Другие формы выражения для внутренней энергии v молей идеального газа:
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 511; Нарушение авторских прав?; Мы поможем в написании вашей работы!