
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Константы нестойкости ряда комплексных ионов
|
|
|
|
| Химическая формула | Константа нестойкости |
| [HgCl4]2- | 8,5×10-16 |
| [HgBr4]2- | 1,0×10-21 |
| [HgI4]2- | 1,5×10-30 |
| [Hg(CN)4]2- | 4,0×10-42 |
| [Ag(NH3)2]+ | 9,3×10-8 |
| [Ag(NO2)2]- | 1,3×10-3 |
| [Ag(S2O3)2]3- | 1,1×10-13 |
| [Ag(CN)2]- | 1,1×10-21 |
| [Cu(NH 3)4]2+ | 2,1×10-13 |
| [Cu(CN)4]2- | 9,6×10-29 |
| [Ni(NH 3)4]2+ | 9,1×10-8 |
| [Ni(CN)4]2- | 1,0×10-31 |
Примечание: перечисленные ионы в водной среде более устойчивы, чем соответствующие им аквакомплексы.
Таблица 4
Стандартные электродные потенциалы Е0 некоторых металлов
(ряд напряжений)
| Электрод | Е0,B | Электрод | Е0,B |
| Li+/Li | -3,045 | Ni2+/Ni | -0,25 |
| K+/K | -2,924 | Sn2+/Sn | -0,136 |
| Ba2+/Ba | -2,90 | Pb2+/Pb | -0,127 |
| Ca2+/Ca | -2,87 | Fe3+/Fe | -0,037 |
| Na+/Na | -2,714 | 2H+/H2 | 0,000 |
| Mg2+/Mg | -2,37 | Sb3+/Sb | +0,20 |
| Al3+/Al | -1,70 | Bi3+/Bi | +0,215 |
| Ti2+/Ti | -1,603 | Cu2+/Cu | +0,34 |
| Mn2+/Mn | -1,18 | Cu+/Cu | +0,52 |
| Cr2+/Cr | -0,913 | Hg22+/2Hg | +0,79 |
| Zn2+/Zn | -0,763 | Ag+/Ag | +0,80 |
| Cr3+/Cr | -0,74 | Hg2+/Hg | +0,85 |
| Fe2+/Fe | -0,44 | Pt2+/Pt | +1,19 |
| Cd2+/Cd | -0,403 | Au3+/Au | +1,50 |
| Co2+/Co | -0,277 | Au+/Au | +1,70 |
Таблица 5
Значения электроотрицательностей (χ, 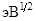 ) и энергий диссоциаций (D, эВ) гомоатомных ковалентных связей атомов щелочных металлов и галогенов
) и энергий диссоциаций (D, эВ) гомоатомных ковалентных связей атомов щелочных металлов и галогенов
| Щелочной металл | χ | D |  Галоген Галоген
| χ | D |
| Li Na K Rb Cs | 0,98 0,85 0,81 0,77 0,65 | 1,14 0,75 0,53 0,51 0,46 | F Cl Br I At | 3,68 3,13 2,99 2,74 2,4 | 1,65 2,52 2,00 1,57 1,23 |
| СОДЕРЖАНИЕ: | |
| Введение …………………………………………………………… | |
| Рекомендуемая литература………………………………………... Эквивалент. Закон эквивалентов………………………………….. | |
| Строение атомов…………………………………………………… | |
| Периодическая система химических элементов…………………. | |
| Химическая связь…………………………………………………... | |
| Энергетика химических процессов……………………………….. | |
| Химическое сродство……………………………………………… | |
| Скорость химических реакций……………………………………. | |
| Химическое равновесие…………………………………………… | |
| Коллигативные свойства растворов………………………………. | |
| Ионно-молекулярные реакции обмена…………………………... | |
| Гидролиз солей……………………………………………………... | |
| Окислительно-восстановительные реакции……………………… | |
| Электродные процессы и гальванические элементы……………. | |
| Электролиз солей…………………………………………………... | |
| Коррозия металлов…………………………………………………. | |
| Комплексные соединения…………………………………………. | |
| Химические свойства металлов…………………………………… | |
| Полимеры…………………………………………………………… | |
| Дисперсные системы………………………………………………. | |
| Количественный анализ…………………………………………… | |
| Приложения………………………………………………………… | |
| Содержание………………………………………………………… | |
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 664; Нарушение авторских прав?; Мы поможем в написании вашей работы!