
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Г л а в а 336. Болезни околощитовидных желез и другие гипер-и гипокальциемические состояния 2 страница
|
|
|
|
Фармакология витамина D и его метаболитов
Имеющиеся в продаже препараты витаминов содержат по 400 ME витамина D2 или D3. В больших дозах витамин D (кальциферол) выпускается в виде капсул и таблеток (50 000 ME), в масляном растворе (500 000 МЕ/мл) и в растворе для перорального применения (8000 МЕ/мл). После однократного приема внутрь 50 000 ME витамина D концентрация его в крови повышается через 12—24 ч с менее 10 нг/мл до 50—100 нг/мл. Период его полужизни в плазме равен примерно 2 дням. Концентрация 25(OH)D и 1,25(OH)2D не меняется. При дефиците витамина D введение его дважды в неделю по 50 000 ME в течение нескольких недель восстанавливает нормальную концентрацию 25(OH)D в сыворотке; при наличии вторичного гиперпаратиреоза содержание 1,25(OH)2D возрастает выше нормы (до 250 нг/мл). 25(OH)D, (кальцифедиол) выпускается в капсулах, содержащих 20 или 50 мкг. Это соединение может быть полезным при дефиците витамина D [низкая концентрация 25(OH)D] у больных с тяжелым нарушением функции печени. В фармакологических дозах его применяют при нарушении метаболизма 25(OH)D. Считают, что в таких дозах 25(OH)D3 оказывает эффект, взаимодействуя с рецепторами 1,25(OH)2D. 1,25(OH)2D3 (кальцитриол) выпускается в капсулах по 0,25 или 0,5 мкг. Кальцитриол эффективен при лечении различных нарушений кальциевого обмена (см. гл. 341). Сильным агонистом 1,25(OH)2D3 является также 1a-гидроксивитамин D3 [1(OH)D3]. По строению этот аналог идентичен природному почечному гормону, за тем лишь исключением, что лишен ОН-группы у С25 (рис. 335-5). У человека он быстро превращается в печени в 1,25(OH)2D3. Этот аналог используют в странах Европы и в Японии.
При химических воздействиях на молекулу витамина D, приводящих к повороту кольца А на 180", С3-b-ОН принимает геометрическое положение, имитирующее положение С1-a-ОН (см. рис. 335-5). К соответствующим соединениям, называемым аналогами псевдо-1a-гидроксивитамина D, относятся дигидротахистерол и 5,6-транс-витамин D3. При равных количествах (по весу) эти аналоги слабее, чем витамин D или 1,25(OH)2D3, стимулируют транспорт ионов кальция в кишечнике. Однако поскольку для приобретения активности в отношении кишечного транспорта кальция нет необходимости в их почечном 1a-гидроксилировании, активность этих препаратов при патологических состояниях, оказывающих отрицательное воздействие на почечную 25(OH)D-1a-гидроксилазу (гипопаратиреоз и хроническая почечная недостаточность), в 3—10 раз превышает активность витамина D. В печени эти аналоги быстро превращаются в соответствующие 25-гидроксипроизводныс, которые и представляют собой биологически активные формы.
Паратиреоидный гормон
Физиология. Функция паратиреоидного гормона заключается в поддержании концентрации кальция во внеклеточной жидкости. Он действует непосредственно на кости и почки и опосредованно — на кишечник, влияя на синтез 1,25(OH)2D3, что повышает уровень кальция в сыворотке. Продукция паратиреоидного гормона строго регулируется концентрацией ионизированного кальция в сыворотке. Эта система обратной связи — один из важнейших гемостатических механизмов, жестко регулирующих уровень кальция во внеклеточной жидкости. Любой тенденции к гипокальциемии, которая могла бы возникнуть при недостаточном содержании кальция в диете, противодействует повышение скорости секреции паратиреоидного гормона. В результате: 1) возрастает скорость растворения минерального вещества кости, что приводит к увеличению поступления кальция из костей в кровь; 2) снижается почечный клиренс кальция, что способствует возвращению во внеклеточную жидкость большего количества фильтруемого в клубочках кальция; 3) увеличивается всасывание кальция в кишечнике. Физиологическое значение трех этих эффектов паратиреоидного гормона — стимуляции транспорта кальция в костях, почках и кишечнике — неясно. Большинство данных свидетельствует о том, что быстрые изменения уровня кальция в крови определяются действием гормона на кости и в меньшей степени — на почечный клиренс кальция. С другой стороны, длительное поддержание кальциевого баланса определяется, по-видимому, влиянием гормона на уровень 1,25(OH)2D3 и, следовательно, на эффективность всасывания кальция в кишечнике. Изучение кинетики кальция показывает, что ежесуточно между внеклеточной жидкостью и костью перемещается до 500 мг кальция (огромное количество, если учесть общее содержание кальция во внеклеточной жидкости), причем главным регулятором этого перемещения служит паратиреоидный гормон. Действие последнего направлено на быстрое восстановление концентрации кальция

Рис. 335-5. При обработке витамина D йодом (I2) или восстановлением Н2 кольцо А молекулы витамина поворачивается на 180°, что приводит к пространственной переориентации 3b-ОН-группы в псевдо-1a-ОН-положение. Такие соединения, 5,6-трансвитамин D3 и дигидротахистерол (ДГТ,), называют псевдо-1a-гидроксианалогами витамина D. 1(OH)D3 представляет собой синтетический аналог 1,25(OH)2D3, лишенный С25ОН. Все эти соединения — 1(OH)D3, 5,6-трансвитамин D3 и ДГТ3 — в печени подвергаются С25-гидроксилированию и лишь после этого приобретают биологическую активность.
в крови ценой деструкции кости и высвобождения минералов. Однако большое значение в быстрой регуляции уровня кальция в крови может иметь и влияние паратиреоидного гормона на почки, направленное на сохранение кальция путем усиления реабсорбции фильтруемого иона.
Паратиреоидный гормон оказывает на кости двоякое действие; под его влиянием происходят замещение кальция и реконструкция кости. Скорость выхода кальция из кости в кровь возрастает уже через несколько минут после введения паратиреоидного гормона, но высвобождению кальция предшествует быстрый отток его из крови, по-видимому, в костные клетки. С другой стороны, более длительное влияние паратиреоидного гормона, сводящееся главным образом к увеличению числа и активности остеокластов и общему ускорению реконструкции кости, проявляется лишь через несколько часов после его введения. Помимо действия на костную ткань, паратиреоидный гормон вызывает повышение синтеза белка, сохраняющееся в течение нескольких часов после введения гормона. Пока неясно, отражают ли две группы эффектов паратиреоидного гормона непрерывную последовательность его действия с общим начальным биохимическим механизмом или они не зависят друг от друга. Принято считать, что рецепторами паратиреоидного гормона обладают только остеобласты, но не остеокласты.
Химия. Расшифрованы полные аминокислотные последовательности основных форм
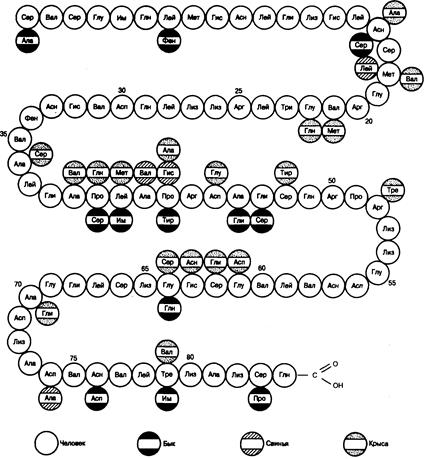
Рис. 335-6. Схема, иллюстрирующая аминокислотную последовательность паратиреоидного гормона человека, быка, крысы и свиньи.
паратиреоидного гормона крупного рогатого скота, свиньи, крысы и человека. Все эти пептиды представляют собой одноцепочечную структуру, состоящую из 84 аминокислотных остатков. Молекула гормона лишена цистеина или цистина. Как показано на рис. 335-6, три вида гормона имеют сходные последовательности.
Определены те структурные особенности, которые необходимы для связывания гормона с рецепторами и, следовательно, его биологической активности. Синтетические фрагменты, содержащие аминоконцевую последовательность, воcпроизводят известные влияния гормона на транспорт ионов кальция в почках и костях, а также (путем стимуляции почечной 25-гидроксивитамин D-1a-гидроксилазы) на всасывании кальция в кишечнике. Поскольку рецепторами паратиреоидного гормона обладают остеобласты и фибробласты, но не остеокласты, стимуляция этим гормоном резорбции кости остеокластами — эффект непрямой.
Укорочение фрагментов с аминоконца вначале приводит к потере способности вызывать биологическую реакцию, а затем уже сродства к рецепторам. Пептид 7—34 является конкурентным ингибитором как связывания активного гормона с рецепторами in vitro, так и реакции почек на гормон, в том числе повышения экскреции циклического АМФ и клиренса фосфата. В некоторых тест-системах in vivo блокируется и быстрая мобилизация кальция из костей.
Любой фрагмент паратиреоидного гормона, чтобы оказать биологическое действие на кости и почки, должен содержать непрерывную пептидную последовательность, начиная со 2-го остатка — валина и до 26-го остатка — лизина.
Эти данные представляют особый интерес в связи со сложностью биосинтеза и периферического метаболизма паратиреоидного гормона.
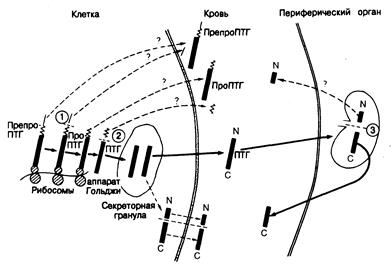
Рис. 335-7. Схематическое изображение биосинтеза, секреции и периферического метаболизма паратиреоидного гормона, а также значения этих процессов для гетерогенности иммунореактивного паратиреоидного гормона в крови (см. текст).
Биосинтез включает начальную трансляцию специфической информационной РНК (иРНК) паратиреоидного гормона в полипептид, состоящий из 115 аминокислот — препропаратиреоидный гормон (пре-проПТГ), вслед за чем происходят специфические посттрансляционные расщепления. Первое расщепление (1) осуществляется уже в первые секунды синтеза в эндоплазматическом ретикулуме или вблизи него; при этом удаляется 25-членный специфический для препроПТГ пептид, или лидерная последовательность (показана тонкой прямой линией). На продукт, проПТГ, состоящий из 90 аминокислот, действует вторая специфическая пептидаза (пептидазы), которая удаляет еще один специфический пептид (показанный ломаной линией) с образованием ПТГ. (Возможен и другой путь — проПТГ превращается в ПТГ после упаковки в секреторные гранулы.) ПТГ, состоящий из 84 аминокислотных остатков [показанный жирной линией с М-(амино) и С-(карбокси) концами] — главный продукт клеточной секреции, происходящей путем экзоцитоза содержащих гормон секреторных гранул (показано жирной стрелкой). Имеются некоторые сообщения, согласно которым существует и альтернативный путь секреции: аминоконцевые (N-) и карбоксиконцевые (С-) фрагменты молекулы образуются в ходе дальнейшего протеолитического процессинга в клетке с последующим выходом их в кровь (пунктирные стрелки). Предположения (пока не доказанные), касающиеся выхода из клетки в кровь предшественников или фрагментов, показаны пунктирными стрелками с вопросительным знаком. Периферический метаболизм включает поглощение интактного гормона некоторыми органами (наиболее вероятно, печенью и почками), где происходит третье расщепление (3). Считают, что это последнее расщепление приводит к образованию аминоконцевого (N-) и карбоксиконцевого (С-) фрагментов. Карбоксиконцевои фрагмент возвращается в кровь, откуда он элиминируется медленнее, чем интактный гормон. Поэтому концентрация карбоксиконцевого фрагмента выше, чем интактного ПТГ. Судьба аминоконцевого фрагмента, предположительно образующегося в процессе периферического метаболизма, остается неизвестной. Требует выяснения также вопрос об относительном значении периферического метаболизма и непосредственного высвобождения фрагментов из железы для гетерогенности паратиреоидного гормона в крови.
Биосинтез, секреция, метаболизм и механизм действия. На пути от транскрипции генов и трансляции до окончательной упаковки 84-членного пептида в предназначенные к секреции гранулы идентифицирован ряд более крупных молекулярных форм гормона (рис. 335-7). Самая ранняя из прекурсорных форм, называемая препропаратиреоидным гормоном, состоит из 115 аминокислотных остатков; эта молекулярная форма превращается в промежуточную форму из 90 аминокислотных остатков, называемую пропаратиреоидным гормоном. Подробности внутриклеточной регуляции биосинтеза неизвестны. Такой сложный путь от первоначального синтеза в виде более крупной молекулы, которая затем еще до секреции уменьшается в размерах в результате нескольких расщеплений, свойствен не только паратиреоидному гормону, но и другим полипептидам и белкам, предназначенным к секреции из клеток. Гидрофобные участки препропаратиреоидного гормона сходны с преучастками других секретируемых клетками белков и могут играть роль посредников, направляющих их транспорт от мест синтеза на полирибосомах через цитоскелет в секреторные гранулы. Гены бычьего, крысиного и человеческого паратиреоидного гормона клонированы, и их структуры расшифрованы. В структурах генов разных видов, равно как и в кодируемых ими белках, имеется высокая степень гомологии.
Секреция паратиреоидного гормона контролируется концентрацией ионов кальция в крови, а именно фракцией ионизированного кальция. При снижении концентрации кальция с нормальной до 75—80 мг/л (по данным определения общего кальция) скорость секреции гормона постепенно возрастает до максимальной, которая в 5 раз превышает исходную. Секреция гормона возрастает под влиянием b-адренергических агонистов и агонистов рецепторов-2 гистамина, но физиологическое значение этих стимуляторов не установлено. Больше того, такие средства, как пропранолол или циметидин, не всегда снижают уровень паратиреоидного гормона в сыворотке.
Магний может изменять секрецию в том же направлении, что и кальций. Хотя физиологические колебания концентрации магния вряд ли отражаются на секреции околощитовидных желез, резкий дефицит внутриклеточного магния нарушает секрецию гормона.
Гормон, секретируемый in vivo нормальными околощитовидными железами быка и человека и паратиреоидными аденомами, не отличается по иммунологическим критериям и размерам молекулы от 84-членного пептида (мол. масса 9500), экстрагируемого из желез. Однако большая часть иммунореактивного материала, обнаруживаемого в периферической крови человека и животных (бык, свинья), имеет меньшие размеры, чем экстрагируемый или секретируемый гормон. Основные циркулирующие фрагменты иммунореактивного гормона (мол. масса приблизительно 7000) лишены важнейшей аминоконцевой последовательности, определяющей биологическую активность, и, следовательно, представляют собой биологически неактивные фрагменты гормона.
Расщепление нативного пептида эндопептидазой должно было бы приводить к появлению и второго фрагмента с мол. массой 2000—3000, который соответствует аминоконцевой биологически активной части гормона. Однако присутствие в крови такого аминоконцевого фрагмента не доказано. Неясно также, что определяет появление в крови фрагмента (фрагментов) гормона — периферический его метаболизм или непосредственная секреция (как и интактного гормона) железой, и является ли периферический метаболизм только катаболическим процессом, ведущим к разрушению гормона, или он приводит к образованию активного аминоконцевого фрагмента паратиреоидного гормона. Последние данные указывают на то, что основными местами периферического метаболизма гормона служат печень и почки. Расщепление его в этих органах могло бы регулировать концентрацию гормонально-активных полипептидов в крови (см. рис. 335-7). В свою очередь на периферический метаболизм могли бы влиять такие патологические процессы, как почечная недостаточность или тяжелая дисфункция печени.
Скорость клиренса секретируемого 84-членного пептида в крови превышает таковую меньшего биологически неактивного фрагмента (фрагментов), образующихся в результате периферического метаболизма. Следовательно, результаты определения уровня паратиреоидного гормона в крови с помощью большинства иммунологических методов дают лишь приблизительное представление об активности околощитовидных желез, а не прямую оценку количества биологически активного гормона, поскольку основную циркулирующую форму иммунореактивного гормона составляют именно биологически инертные фрагменты, а не интактный гормон. Изменение скорости продукции пли клиренса фрагментов может сказываться на концентрации иммунореактивного гормона даже в отсутствие сдвигов в скорости гормональной секреции. Такое расхождение между концентрациями иммунореактивного и биологически активного гормона встречается, например, при почечной недостаточности, так как почки, по-видимому, играют основную роль в экскреции гормональных фрагментов из организма.
Биохимическое действие паратиреоидного гормона включает его влияние на аденилатциклазу клеток-мишеней. Стимуляция активности этого фермента при специфическом взаимодействии гормона с мембраной клетки-мишени приводит к повышению внутриклеточного уровня циклического АМФ (см. также гл. 67). Паратиреоидный гормон взаимодействует с комплексом специфический рецептор — аденилатциклаза на плазматической мембране клетки. Этот комплекс состоит из гормонального рецептора, каталитической ферментной единицы (аденилатциклазы) и регуляторного белка (G- или N-белок), связывающего гуаниловые нуклеотиды (ГТФ или ГДФ) (см. гл. 67). Этот последний белок состоит из a-субъединиц, связывающих ГТФ или ГДФ, и b-субъединиц, которые диссоциируют отбелка, когда a-субъединицы связывают ГТФ и вновь присоединяются к белку, когда a-субъединицы связывают ГДФ. Будучи связанной с ГТФ, a-субъединицакомплексируется с аденилатциклазой, что приводит к активации последней и увеличению скорости образования циклического АМФ из АТФ. Гидролиз ГТФ до ГДФ на a-субъединице обусловливает реассоциацию субъединиц G-белка и снижение активности аденилатциклазы. Коротко говоря, связывание гормона с рецептором запускает цикл связывания ГТФ a-субъединицей и активирует фермент.
После введения паратиреоидного гормона повышение уровня циклического АМФ в моче предшествует сколько-нибудь заметному увеличению экскреции фосфата. Подобно этому, действие на активность аденилатциклазы кости можно обнаружить уже в течение первой минуты после добавления паратиреоидного гормона к суспензии костных клеток. Кроме того, введение дибутирил-циклического АМФ имитирует действие паратиреоидного гормона у паратиреоидэктомированных животных. Дибутирил-циклический АМФ вызывает повышение уровня кальция в сыворотке, снижение содержания в ней фосфата и увеличение экскреции кальция, фосфата и гидроксипролина с мочой.
Механизм, посредством которого повышенная внутриклеточная концентрация циклического АМФ обусловливает сдвиги в транслокации ионов кальция и фосфата, неизвестен. В отдельных чувствительных к гормону тканях, где гормон действует через механизм циклического АМФ, обнаружена стимуляция протеинкиназ, которые в свою очередь обеспечивают фосфорилирование белков, инициирующих гормональный эффект.
Каков бы ни был этот механизм, но первый физиологический эффект (возникающий в течение нескольких минут) паратиреоидного гормона — это гипокальциемия, связанная с оттоком кальция из крови в клетки (по всей вероятности, костные). Таким образом, «вторым посредником» действия паратиреоидного гормона в клетках-мишенях может быть как циклический АМФ, так и кальций.
Патофизиология. При гиперпаратиреозе наблюдается чрезмерная продукция паратиреоидного гормона опухолями околощитовидной железы или гиперплазированными железами, причем гиперплазия затрагивает все железы. Избыток гормона приводит к гиперкальциемии вследствие ускорения всасывания кальция в кишечнике [повышение синтеза 1,25(OH),DJ и снижения почечного клиренса кальция. У большинства больных возрастает также резорбция костной ткани; кругооборот компонентов кости увеличивается у всех больных, но у многих из них процессы резорбции преобладают над процессами образования кости. Реакции отдельных тканей-мишеней (кишечник, почки и кости) на избыток гормона у больных обнаруживают индивидуальные колебания; факторы, обусловливающие различие этих реакций у разных больных, остаются неизвестными (см. гл. 336).
В результате влияния избыточных количеств паратиреоидного гормона па реабсорбцию фосфата в почечных канальцах возникает гипофосфатемия, которая в свою очередь усиливает гиперкальциемию отчасти за счет повышения как синтеза 1,25(ОН)2D3, так и чувствительности кости к резорбции. Гипофосфатемия может также препятствовать нормальной минерализации кости, что создает смешанную картину повышенной резорбции и недостаточной минерализации на соседних участках костей скелета.
Гипопаратиреоз сопровождается гипокальциемией и гиперфосфатемией, т. е. сдвигами, обратными тем, которые наблюдаются при избытке гормона (см. гл. 336).
Кальцитонин (см. гл. 334)
Кальцитонин —это пептидный гормон, обладающий мощным гипокалиемическим и гипофосфатемическим действием, который во многих отношениях выступает в роли физиологического антагониста паратиреоидного гормона. Кальцитонин уменьшает резорбцию костей и влияет на почки противоположным по сравнению к паратиреоидным гормоном образом, т. е. увеличивает клиренс кальция. Эффекты кальцитонина опосредуются стимуляцией связанной с мембранами аденилатциклазы в разных клетках почек и костей, обладающих рецепторами к этому гормону. Чувствительность разных клеток почечных канальцев к кальцитонину, паратиреоидному гормону и вазопрессину неодинакова. В некоторых сегментах нефрона клетки реагируют на все три гормона, но в других — только на один или два из них. Среди костных клеток рецепторами кальцитонина обладают остеокласты.
У млекопитающих основным источником гормона служит щитовидная железа, а клетки, синтезирующие кальцитонин, происходят из ткани нервного гребешка. Во время эмбриогенеза эти клетки мигрируют в ультимобрахиальное тельце, которое образуется из последнего брахиального мешка, почему и называется ультимобрахиальным. У низших позвоночных ультимобрахиальное тельце остается отдельным органом, анатомически несвязанным со щитовидной железой. У млекопитающих же это тельце или железа, сливается со щитовидной железой и включается в нее. Кальцитонин обнаружен у позвоночных всех классов.
Природные кальцитонины состоят из пептидной цепи, насчитывающей 32 аминокислотных остатка. Аминокислотные последовательности в гормонах разных видов существенно различаются. В организме для проявления биологической активности необходима, по-видимому, вся 32-членная цепь, хотя в системах in vitro функционируют и фрагменты гормона. Факторы, регулирующие синтез кальцитонина, неизвестны. В равных по весу количествах кальцитонин лосося в 25—100 раз сильнее снижает уровень кальция в сыворотке млекопитающих, чем другие формы этого гормона. Например, у человека лососевый гормон по крайней мере в 10 раз активнее человеческого кальцитонина. Большая биологическая активность кальцитонина лосося отчасти может объясняться его медленным клиренсом, но он и более прочно связывается с рецепторами. Кальцитонин синтезируется в виде молекулы-предшественника, которая в 4 раза больше самого гормона. При анализе последовательности кодирующих участков гена кальцитонина крысы обнаружили по крайней мере два соседних с кальцитонином пептида, которые отделяются от гормона основными остатками. По аналогии с общим предшественником для АКТГ и эндорфина можно думать, что эти пептиды секретируются вместе с кальцитонином и оказывают эффекты, которые могли бы объяснить, например, некоторые патофизиологические особенности синдромов, обусловленных избыточной продукцией кальцитонина. Имеются два гена кальцитонина — a и b, расположенные на 11-й хромосоме в общей области генов бета-глобина и паратиреоидного гормона. Транскрипция гена кальцитонина — сложный процесс. С b-гена транскрибируются две разные информационные РНК; одна транслируется в предшественник кальцитонина, а другая — в особый продукт: пептид, связанный с геном кальцитонина (ПСГК). Синтез ПСГК сопровождает любую экспрессию мРНК кальцитонина, например, при медуллярном раке щитовидной железы. Ген b транскрибируется в информационную РНК ПСГК в центральной нервной системе млекопитающих, где ПСГК может выполнять роль нейротрансмиттера. У человека в отличие от животных экспрессия b-гена не обнаружена, но предположительно существует.
Секреция кальцитонина находится под непосредственным контролем уровня кальция в крови: при увеличении содержания кальция концентрация кальцитонина повышается, а при падении снижается. Попав в кровь, кальцитонин быстро исчезает из нее, период его полужизни 2—15 мин.
Концентрация кальцитонина в периферической крови здоровых людей ниже, чем у животных многих видов. Базальный и стимулированный уровни иммунореактивного кальцитонина у женщин ниже, чем у мужчин, а тенденция к снижению этих уровней с возрастом у женщин выражена в большей степени.
Физиологическая роль кальцитонина не совсем понятна. У животных кальцитонин снижает содержание в крови как кальция, так и фосфата; в основе этого действия лежит торможение резорбции костной ткани. Увеличение клиренса кальция и фосфора с мочой под действием кальцитонина лишь усиливает проявления его влияния на резорбцию костей. В свою очередь регуляция продукции кальцитонина кальцием сыворотки крови модулирует действие гормона на почки и кость. Таким образом, представление о роли кальцитонина в защите от гиперкальциемии основано на гипокальциемических его эффектах, реализующихся в ответ на гиперкальциемию.
Однако у здоровых взрослых людей роль кальцитонина остается неясной. У человека даже крайние колебания продукции гормона не сопровождаются заметными сдвигами в метаболизме кальция и фосфата. Нет также определенных симптомов, которые можно было бы отнести за счет недостаточности (у тиреоидэктомированных больных, получающих заместительную терапию только тироксином) или избытка (у больных с секретирующей кальцитонин опухолью — медуллярным раком щитовидной железы) кальцитонина. При последнем заболевании больные страдают от множества тяжелейших последствий злокачественного роста (см. гл. 334), но кальциевый или костный метаболизм у них не нарушается, вероятно, потому, что они приобретают резистентность к влиянию кальцитонина на кости скелета.
Поэтому в настоящее время интерес врачей сосредоточен на применении кальцитонина в качестве терапевтического средства или использовании результатов его радиоиммунологического определения для выявления медуллярного рака (см. гл. 334). Кальцитонин с успехом применяют для лечения больных с костной болезнью Педжета.
Джон Т. Поттс, младший (John Т. Potts, Jr.)
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 197; Нарушение авторских прав?; Мы поможем в написании вашей работы!