
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
А. Фософорилирование глюкозы 1 страница
|
|
|
|
В дальнейших превращениях в клетках глюкоза и другие моносахариды участвуют только в виде фосфорных эфиров. Фосфорилирование свободных моносахаридов - обязательная реакция на пути их использования, она приводит к образованию более реакционно-способных соединений и поэтому может рассматриваться как реакция активации.
Глюкоза, поступающая в клетки органов и тканей, сразу же подвергается фосфорилированию с использованием АТФ. Эту реакцию во многих тканях катализирует фермент гексокиназа, а в печени и поджелудочной железе - фермент глюкокиназа. Фосфорилирование глюкозы - практически необратимая реакция, так как она протекает с использованием значительного количества энергии. Образование глюкозо-6-фосфата в клетке - своеобразная "ловушка" для глюкозы, так как мембрана клетки непроницаема для фосфорилированной глюкозы (нет соответствующих транспортных белков). Кроме того, Фосфорилирование уменьшает концентрацию свободной глюкозы в цитоплазме. В результате создаются благоприятные условия для облегчённой диффузии глюкозы в клетки из крови.
Глюкокиназа. Фосфорилирование глюкозы в гепатоцитах в период пищеварения обеспечивается свойствами глюкокиназы, которая имеет высокое значение Кm - 10 ммоль/л. В этот период концентрация глюкозы в воротной вене больше, чем в других отделах кровяного русла и может превышать 10 ммоль/л, а следовательно, активность глюкокиназы в гепатоцитах повышается. Следует отметить, что активность глюкокиназы, в отличие от гексокиназы, не ингибируется продуктом катализируемой реакции - глюкозо-6-фосфатом. Это обстоятельство обеспечивает повышение концентрации глюкозы в клетке в фосфорилированной форме, соответственно её уровню в крови. Как уже упоминалось, глюкоза проникает в гепатоциты путём облегчённой диффузии при участии транспортёра ГЛЮТ-2 (независимого от инсулина). ГЛЮТ-2, так же, как глюкокиназа, имеет высокую Кm, что способствует повышению скорости поступления глюкозы в гепатоциты в период пищеварения, следовательно, ускоряет её фосфорилирование и дальнейшее использование для депонирования.
Хотя инсулин и не влияет на транспорт глюкозы, он усиливает приток глюкозы в гепатоциты в период пищеварения косвенным путём, индуцируя синтез глюкокиназы и ускоряя тем самым Фосфорилирование глюкозы.
Преимущественное потребление глюкозы гепатоцитами, обусловленное свойствами глюкокиназы,
предотвращает чрезмерное повышение её концентрации в крови в абсорбтивном периоде. Это, в свою очередь, снижает последствия протекания нежелательных реакций с участием глюкозы, например гликозилирования белков.
Гексокиназа отличается от глюкокиназы высоким сродством к глюкозе (Кm <0,1 ммоль/л). Следовательно, этот фермент, в отличие от глюкокиназы, активен при низкой концентрации глюкозы в крови, что характерно для постабсорбтивного состояния. Печень в этот период поглощает гораздо меньше глюкозы, так как скорость её внутриклеточного фосфорилирования глюкокиназой резко снижается. Тогда как потребление глюкозы мозгом, эритроцитами и другими тканями обеспечивается активной в этих условиях гексокиназой. Фермент гексокиназа может катализировать фосфорилирование не только D-глюкозы, но и других гексоз, хотя и с меньшей скоростью. Активность гексокиназы изменяется в зависимости от потребностей клетки в энергии. В качестве регуляторов выступают соотношение АТФ/АДФ и внутриклеточный уровень глюкозо-6-фосфата (продукта катализируемой реакции). При снижении расхода энергии в клетке повышается уровень АТФ (относительно АДФ) и глюкозо-6-фосфата. В этом случае активность гексокиназы снижается, и, следовательно, уменьшается скорость поступления глюкозы в клетку.
Следует отметить, что в разных тканях гексокиназа присутствует в различных изоформах, отличающихся величиной Кm. Глюкокиназа печени (и почек) является изоформой IV (гексокиназа IV). В клетках мышц содержится гексокиназа II, а в клетках опухолевых тканей преобладает гексокиназа III, с более высоким, чем у гексокиназы II, сродством к глюкозе.
Б. Дефосфорилирование глюкозо-6-фосфата
Превращение глюкозо-6-фосфата в глюкозу возможно в печени, почках и клетках эпителия кишечника. В клетках этих органов имеется фермент глюкозо-6-фосфатаза, катализирующая отщепление фосфатной группы гидролитическим путём:
Глюкозо-6-фосфат +Н2О → Глюкоза + Н3РО4
Образовавшаяся свободная глюкоза способна диффундировать из этих органов в кровь. В других органах и тканях глюкозо-6-фосфатазы нет, и поэтому дефосфорилирование глюкозо-6-фосфата невозможно. Пример подобного необратимого проникновения глюкозы в клетку - мышцы, где глюкозо-6-фосфат может использоваться только в метаболизме этой клетки.
В. Метаболизм глюкозо-6-фосфата
Глюкозо-6-фосфат может использоваться в клетке в различных превращениях, основными из которых являются: синтез гликогена, катаболизм с образованием СО2 и Н2О или лактата, синтез пентоз. Распад глюкозы до конечных продуктов служит источником энергии для организма. Вместе с тем в процессе метаболизма глюкозо-6-фосфата образуются промежуточные продукты, используемые в дальнейшем для синтеза аминокислот, нуклеотидов, глицерина и жирных кислот. Таким образом, глюкозо-6-фосфат - не только субстрат для окисления, но и строительный материал для синтеза новых соединений (рис. 7-20).
315:: 316:: Содержание
316:: 317:: 318:: 319:: 320:: 321:: 322:: Содержание
VI. МЕТАБОЛИЗМ ГЛИКОГЕНА
Многие ткани синтезируют в качестве резервной формы глюкозы гликоген. Синтез и распад гликогена обеспечивают постоянство концентрации глюкозы в крови и создают депо для её использования тканями по мере необходимости.
А. Строение и функции гликогена
Гликоген - разветвлённый гомополимер глюкозы, в котором остатки глюкозы соединены в линейных участках α-1,4-гликозидной связью. В точках ветвления мономеры соединены α-1,6-гликозидными связями. Эти связи образуются примерно с каждым десятым остатком глюкозы. Следовательно, точки ветвления в гликогене встречаются примерно через каждые десять остатков глюкозы. Так возникает древообразная структура с молекулярной массой >107Д, что соответствует приблизительно 50 000 остатков глюкозы (рис. 7-21). Таким образом, в молекуле гликогена имеется только одна свободная аномерная ОН-группа и, следовательно, только один восстанавливающий (редуцирующий) конец.

Рис. 7-20. Метаболизм глюкозо-6-фосфата.
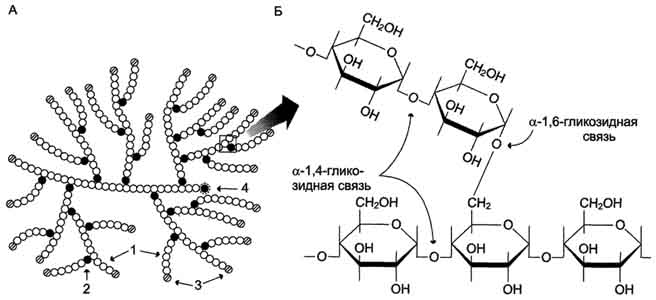
Рис. 7-21. Структура гликогена. А. Строение молекулы гликогена: 1 - остатки глюкозы, соединённые α-1,4-гликозидной связью; 2 - остатки глюкозы, соединённые α-1,6-гликозидной связью; 3 - нередуцирующие концевые мономеры; 4 - редуцирующий концевой мономер. Б. Строение отдельного фрагмента молекулы гликогена.
В клетках животных гликоген - основной резервный полисахарид. При полимеризации глюкозы снижается растворимость образующейся молекулы гликогена и, следовательно, её влияние на осмотическое давление в клетке. Это обстоятельство объясняет, почему в клетке депонируется гликоген, а не свободная глюкоза.
Гликоген хранится в цитозоле клетки в форме гранул диаметром 10-40 нм. С гранулами связаны и некоторые ферменты, участвующие в метаболизме гликогена, что облегчает их взаимодействие с субстратом. Разветвлённая структура гликогена обусловливает большое количество концевых мономеров, что способствует работе ферментов, отщепляющих или присоединяющих мономеры при распаде или синтезе гликогена, так как эти ферменты могут одновременно работать на нескольких ветвях молекулы. Гликоген депонируется главным образом в печени и скелетных мышцах.
После приёма пищи, богатой углеводами, запас гликогена в печени может составлять примерно 5% от её массы. В мышцах запасается около 1% гликогена, однако масса мышечной ткани значительно больше и поэтому общее количество гликогена в мышцах в 2 раза больше, чем в печени. Гликоген может синтезироваться во многих клетках, например в нейронах, макрофагах, клетках жировой ткани, но содержание его в этих тканях незначительно. В организме может содержаться до 450 г гликогена.
Распад гликогена печени служит в основном для поддержания уровня глюкозы в крови в постабсорбтивном периоде. Поэтому содержание гликогена в печени изменяется в зависимости от ритма питания. При длительном голодании оно снижается почти до нуля. Гликоген мышц служит резервом глюкозы - источника энергии при мышечном сокращении. Мышечный гликоген не используется для поддержания уровня глюкозы в крови. Как уже упоминалось ранее, в клетках мышц нет фермента глюкозо-6-фосфатазы, и образование свободной глюкозы невозможно. Расход гликогена в мышцах зависит в основном от физической нагрузки (рис. 7-22).
Б. Синтез гликогена (гликогеногенез)
Гликоген синтезируется в период пищеварения (через 1-2 ч после приёма углеводной пищи). Следует отметить, что синтез гликогена из глюкозы (рис. 7-23), как и любой анаболический процесс, является эндергоническим, т.е. требующим затрат энергии.

Рис. 7-22. Функции гликогена в печени и мышцах.
Глюкоза, поступающая в клетку, фосфорилируется при участии АТФ (реакция 1). Затем глюкозо-6-фосфат в ходе обратимой реакции превращается в глюкозо-1 -фосфат (реакция 2) под действием фермента фосфоглюкомутазы. Глюкозо-1-фосфат по термодинамическому состоянию мог бы служить субстратом для синтеза гликогена. Но в силу обратимости реакции глюкозо-6-фосфат ↔ глюкозо-1-фосфат синтез гликогена из глюкозо-1-фосфата и его распад оказались бы также обратимыми и поэтому неконтролируемыми. Чтобы синтез гликогена был термодинамически необратимым, необходима дополнительная стадия образования уридинди-фосфатглюкозы из УТФ и глюкозо-1-фосфата (реакция 3). Фермент, катализирующий эту реакцию, назван по обратной реакции: УДФ-глюкопирофосфорилаза. Однако в клетке обратная реакция не протекает, потому что образовавшийся в ходе прямой реакции пирофосфат очень быстро расщепляется пирофосфатазой на 2 молекулы фосфата (рис. 7-24).
Реакция образования УДФ-глюкозы обусловливает необратимость всей серии реакций, протекающих при синтезе гликогена. Этим же объясняется невозможность протекания распада
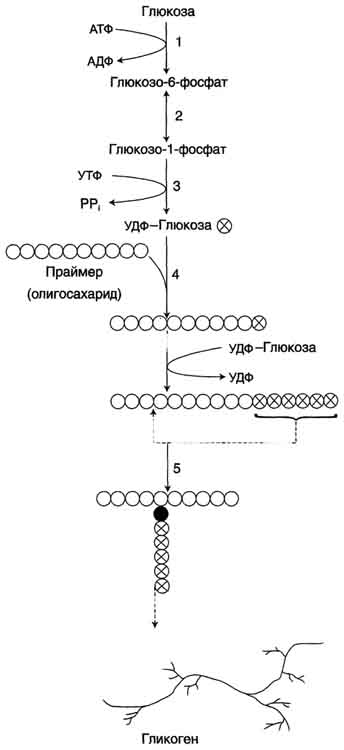
Рис. 7-23. Синтез гликогена. 1 - глюкокиназа или гексокиназа; 2 - фосфоглюкомутаза; 3 - УДФ-глюкрпирофосфорилаза; 4 - гликогенсинтаза (глюкозилтрансфераза); 5 - фермент "ветвления" (амило-1,4 → 1,6-глюкозилтрансфераза), светлые и заштрихованные кружки - глюкозные остатки, закрашенные кружки - глюкозные остатки в точке ветвления.

Рис. 7-24. Образование УДФ-глюкозы.
гликогена путём простого обращения процесса его синтеза.
Образованная УДФ-глюкоза далее используется как донор остатка глюкозы при синтезе гликогена (рис. 7-23, реакция 4). Эту реакцию катализирует фермент гликогенсинтаза (глюкозилтрансфераза). Поскольку в данной реакции не используется АТФ, фермент называют син-тазой, а не синтетазой. Нуклеотидная часть УДФ-глюкозы играет существенную роль в действии гликоген синтазы, выполняя функцию "рукоятки", при помощи которой фермент располагает глюкозу в полисахаридной цепи в нужном положении. Кроме того, нуклеотидная часть УДФ-глюкозы, по-видимому, необходима для узнавания субстрата при катализе.
Так как гликоген в клетке никогда не расщепляется полностью, синтез гликогена осуществляется путём удлинения уже имеющейся молекулы полисахарида, называемой "затравка", или "праймер". К "затравке" последовательно присоединяются молекулы глюкозы. Строением молекулы "затравки" как бы предопределяется тип связи, который возникает в реакции трансгли-козилирования. Таким образом, синтезируется полисахарид, аналогичный по строению с "затравочным". В состав "затравки" может входить белок гликогенин, в котором к ОН-группе одного из тирозиновых остатков присоединена олигосахаридная цепочка (примерно 8 остатков глюкозы). Глюкозные остатки переносятся гликогенсинтазой на нередуцирующий конец олигосахарида и связываются α-1,4-гликозидными связями. По окончании синтеза гликогенин остаётся включённым в гранулу гликогена.
Разветвлённая структура гликогена образуется при участии амило-1,4 →1,6-глюкозилтрансферазы, называемой ферментом "ветвления" (от англ, branching enzyme). Как только гликогенсинтаза удлиняет линейный участок примерно до 11 глюкозных остатков, фермент ветвления переносит её концевой блок, содержащий 6-7 остатков, на внутренний остаток глюкозы этой или другой цепи. В точке ветвления концевой остаток глюкозы олигосахарида соединяется с гидроксильной группой в С6 положении с образованием α-1,6-гликозидной связи. Новая точка ветвления может быть образована на расстоянии не менее 4 остатков от любой уже существующей. Таким образом, по мере синтеза гликогена многократно возрастает число ветвлений. Концы цепей служат точками роста молекулы при её синтезе и началом при её распаде.
В. Распад гликогена (гликогенолиз)
Распад гликогена или его мобилизация происходят в ответ на повышение потребности организма в глюкозе. Гликоген печени распадается в основном в интервалах между приёмами пищи, кроме того, этот процесс в печени и мышцах ускоряется во время физической работы.
Распад гликогена (рис. 7-25) происходит путём последовательного отщепления остатков глюкозы в виде глюкозо-1-фосфата. Гликозидная связь расщепляется с использованием неорганического фосфата, поэтому процесс называется фосфоролизом, а фермент гликогенфосфорилазой.
Так же как и синтез, расщепление гликогена начинается с нередуцирующего конца полисахаридной
цепи. При этом наличие разветвлённой структуры гликогена облегчает быстрое высвобождение глюкозных остатков, так как чем больше концов имеет молекула гликогена, тем больше молекул гликогенфосфорилазы могут действовать одновременно.
Гликогенфосфорилаза расщепляет только α-1,4-гликозидные связи (реакция 1). Последовательное отщепление глюкозных остатков прекращается, когда до точки ветвления остаётся 4 мономера. Подобная особенность в действии гликогенфосфорилазы обусловлена размером и строением её активного центра.
Дальнейший распад гликогена требует участия двух других ферментов. Сначала три оставшихся до точки ветвлении глюкозных остатка переносятся при участии олигосахаридтрансферазы (реакция 2) на нередуцирующий конец соседней цепи, удлиняя её и таким образом создавая условия для действия фосфорилазы. Оставшийся в точке ветвления глюкозный остаток гидролитически отщепляется с помощью α-1,6-глюкозидазы в виде свободной глюкозы (реакция 3), после чего неразветвлённый участок гликогена может вновь атаковаться фосфорилазой.
Считают, что перенос трёх остатков глюкозы и удаление мономера из точки ветвления (реакции 2 и 3) катализирует один и тот же фермент, который обладает двумя разными ферментативными активностями - трансферазной и гликозидазной. Его называют "деветвящим" ферментом (от англ, debranching enzyme).
Продукт действия гликогенфосфорилазы - глюкозо-1-фосфат - затем изомеризуется в глюкозо-6-фосфат фосфоглюкомутазой. Далее глюкозо-6-фосфат включается в процесс катаболизма или другие метаболические пути. В печени (но не в мышцах) глюкозо-6-фосфат может гидролизоваться с образованием глюкозы, которая выделяется в кровь. Эту реакцию катализирует фермент глюкозо-6-фосфатаза. Реакция протекает в просвете ЭР, куда с помощью специального белка транспортируется глюкозо-6-фосфат. Фермент локализован на мембране ЭР таким образом, что его активный центр обращён в просвет ЭР. Продукты гидролиза (глюкоза и неорганический фосфат) возвращаются в цитоплазму также с помощью транспортных систем.

Рис. 7-25. Распад гликогена. В рамке - фрагмент гликогена с точкой ветвления. Закрашенный кружок - глюкозный остаток, связанный α-1,6-гликозидной связью; светлые и заштрихованные кружки - глюкозные остатки в линейных участках и боковых ветвях, связанные α-1,4-гликозидной связью. 1 - Гликогенфосфорилаза; 2 - олигосахаридтрансфераза; 3 - α-1,6-глюкозидаза.
Г. Биологическое значение обмена гликогена в печени и мышцах
На рисунке 7-26 приведена общая схема синтеза и распада гликогена и регуляция этих процессов гормонами.
Сравнение этих процессов позволяет сделать следующие выводы:
- синтез и распад гликогена протекают по разным метаболическими путям;
- печень запасает глюкозу в виде гликогена не столько для собственных нужд, сколько для поддержания постоянной концентрации глюкозы в крови, и, следовательно, обеспечивает поступление глюкозы в другие ткани. Присутствие в печени глюкозо-6-фосфатазы обусловливает эту главную функцию печени в обмене гликогена;
- функция мышечного гликогена заключается в освобождении глюкозо-6-фосфата, потребляемого в самой мышце для окисления и использования энергии;
- синтез гликогена - процесс эндергонический. Так на включение одного остатка глюкозы в полисахаридную цепь используется 1 моль АТФ и 1 моль УТФ;
- распад гликогена до глюкозо-6-фосфата не требует энергии;
- необратимость процессов синтеза и распада гликогена обеспечивается их регуляцией.
316:: 317:: 318:: 319:: 320:: 321:: 322:: Содержание
322:: 323:: 324:: 325:: 326:: 327:: 328:: 329:: 330:: 331:: 332:: 333:: Содержание
VII. РЕГУЛЯЦИЯ МЕТАБОЛИЗМА ГЛИКОГЕНА
Процессы накопления глюкозы в виде гликогена и его распада должны быть согласованы с потребностями организма в глюкозе как источнике энергии. Одновременное протекание этих метаболических путей невозможно, так как в этом случае образуется "холостой" цикл, существование которого приводит только к бесполезной трате АТФ.
Изменение направления процессов в метаболизме гликогена обеспечивают регуляторные механизмы, в которых участвуют гормоны. Переключение процессов синтеза и мобилизации гликогена происходит при смене абсорбтивного периода на постабсорбтивный или состояния покоя организма на режим физической работы. В переключении этих метаболических путей в печени участвуют гормоны инсулин, глюкагон и адреналин, а в мышцах - инсулин и адреналин.
А. Характеристика гормонов, регулирующих обмен гликогена
Первичным сигналом для синтеза и секреции инсулина и глюкагона является изменение уровня глюкозы в крови. В норме концентрация глюкозы в крови соответствует 3,3-5,5 ммоль/л (60- 100 мг/дл).
Инсулин - белковый гормон, синтезируется и секретируется в кровь р-клетками островков Лангерханса поджелудочной железы, β-клетки чувствительны к изменениям содержания глюкозы в крови и секретируют инсулин в ответ на повышение её содержания после приёма пищи. Транспортный белок (ГЛЮТ-2), обеспечивающий поступление глюкозы в β-клетки, отличается низким сродством к ней. Следовательно, этот белок транспортирует глюкозу в клетку поджелудочной железы лишь после того, как её содержание в крови будет выше нормального уровня (более 5,5 ммоль/л).
В β-клетках глюкоза фосфорилируется глюкокиназой, имеющей также высокую Кm для глюкозы - 12 ммоль/л. Скорость фосфорилирования глюкозы глюкокиназой в β-клетках прямо пропорциональна её концентрации в крови.
Синтез инсулина регулируется глюкозой. Глюкоза (или её метаболиты), по-видимому, непосредственно участвуют в регуляции экспрессии гена инсулина. Секреция инсулина и глюкагона также регулируется глюкозой, которая стимулирует секрецию инсулина из β-клеток и подавляет секрецию глюкагона из α-клеток. Кроме того, сам инсулин снижает секрецию глюкагона (см. раздел 11).
Глюкагон - "гормон голода", вырабатываемый α-клетками поджелудочной железы в ответ на снижение уровня глюкозы в крови. По химической природе глюкагон - пептид.
Адреналин выделяется из клеток мозгового вещества надпочечников в ответ на сишалы нервной системы, идущие из мозга при возникновении экстремальных ситуаций (например, бегство или борьба), требующих внезапной мышечной деятельности. Адреналин является сигналом "тревоги". Он должен мгновенно обеспечить мышцы и мозг источником энергии.
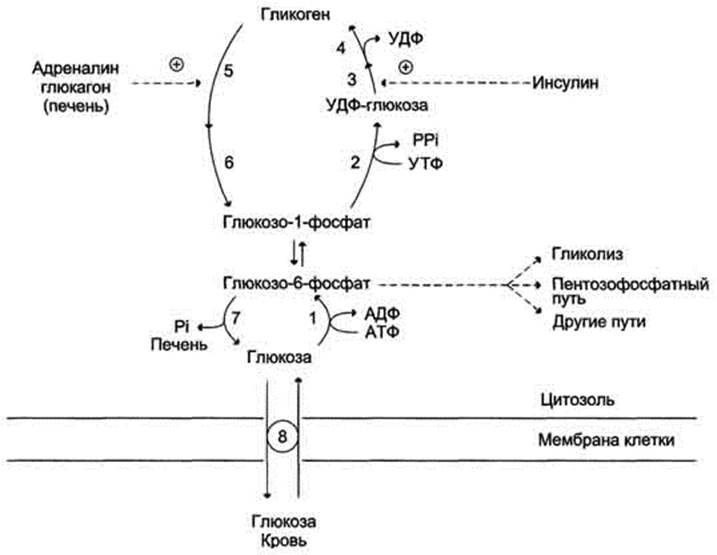
Рис. 7-26. Синтез и распад гликогена. 1 - гексокиназа или глюкокиназа (печень); 2 - УДФ-глюкопирофосфорилаза; 3 - гликогенсинтаза; 4 - амило-1,4 → 1,6-глюкозилтрансфераза (фермент ветвления); 5 - гликогенфосфорилаза; 6 - "деветвящий" фермент; 7 - глюкозо-6-фосфатаза (печень); 8 - транспортные системы ГЛЮТ.
Б. регуляция активности гликогенфосфорилазы и глигогенсинтазы
Поскольку синтез и распад гликогена протекают по различным метаболическим путям, эти процессы могут контролироваться реципрокно. Влияние гормонов на синтез и распад гликогена осуществляется путём изменения в противоположных направлениях активности двух ключевых ферментов: гликогенсинтазы и гликогенфосфорилазы с помощью их фосфорилирования и дефосфорилирования (рис. 7-27).
Гликогенфосфорилаза существует в 2 формах:
1) фосфорилированная - активная (форма а);
2) дефосфорилированная - неактивная (форма в).
Фосфорилирование осущеспшяется путём переноса фосфатного остатка с АТФ на гидроксильную группу одного из сериновых остатков фермента. Следствие этого - конформационные изменения молекулы фермента и его активация.
Взаимопревращения 2 форм гликогенфосфорилазы обеспечиваются действием ферментов киназы фосфорилазы и фосфопротеинфосфатазы (фермент, структурно связанный с молекулами гликогена). В свою очередь, активность киназы фосфорилазы и фосфопротеинфосфатазы также регулируется путём фосфорилирования и дефосфорилирования.
Активация киназы фосфорилазы происходит под действием протеинкиназы А - ПКА (цАМФ-зависимой). цАМФ сначала активирует протеинкиназу А, которая фосфорилирует киназу фосфорилазы, переводя её в активное состояние, а та, в свою очередь, фосфорилирует гликогенфосфорилазу. Синтез цАМФ стимулируется адреналином и глюкагоном (см. раздел 5).
Активация фосфопротеинфосфатазы происходит в результате реакции фосфорилирования, катализируемой специфической протеинкиназой, которая, в свою очередь, активируется инсулином посредством каскада реакций с участием

Рис. 7-27. Изменение активности гликогенфосфорилазы и гликогенсинтазы. Кружками обозначены молекулы фермента: активные - чёрные, неактивные - белые. ФП-фосфатаза (ГР) - фосфопротеинфосфатаза гранул гликогена.
Ras-белка, а также других белков и ферментов (сигнальный Ras-путъ, см. раздел 11). Активируемая инсулином протеинкиназа фосфорилирует и тем самым активирует фосфопротеинфосфатазу. Активная фосфопротеинфосфатаза дефосфорилирует и, следовательно, инактивирует киназу фос-форилазы и гликогенфосфорилазу (рис. 7-28).
Активность гликогенсинтазы также изменяется в результате фосфорилирования и дефосфорилирования (см. выше рис. 7-27). Однако есть существенные различия в регуляции гликогенфосфорилазы и гликогенсинтазы:
- фосфорилирование гликогенсинтазы катализирует ПК А и вызывает её инактивацию;
- дефосфорилирование гликогенсинтазы под действием фосфопротеинфосфатазы, наоборот, её активирует.
В. Регуляция метаболизма гликогена в печени
Как уже отмечалось, первичный сигнал для синтеза инсулина и глюкагона - изменение концентрации глюкозы в крови. Инсулин и глюкагон постоянно присутствуют в крови, но при смене абсорбтивного периода на постабсорбтивный изменяется их относительная концентрация, что является главным фактором, переключающим метаболизм гликогена в печени. Отношение концентрации инсулина в крови к концентрации глюкагона называют "инсулинглюкагоновый индекс". В постабсорбтивном периоде инсулинглюкагоновый индекс снижается, и решающее значение в регуляции концентрации глюкозы в крови приобретает концентрация глюкагона.
Глюкагон для гепатоцитов служит внешним сигналом о необходимости выделения в кровь глюкозы за счёт распада гликогена (гликогенолиза) или синтеза глюкозы из других веществ - глюконеогенеза (этот процесс будет изложен позднее). Гормон связывается с рецептором на плазматической мембране и активирует при посредничестве G-белка аденилатциклазу, которая катализирует образование цАМФ из АТФ (см. раздел 5). Далее следует каскад реакций, приводящий в печени к активации гликогенфосфорилазы и ингибированию гликогенсинтазы (рис. 7-29). Этот механизм приводит к высвобождению из гликогена глюкозо-1-фосфата, который превращается в глюкозо-6-фосфат. Затем под влиянием глюкозо-6-фосфатазы образуется свободная глюкоза, способная выйти из клетки в кровь. Таким образом, глюкагон в печени, стимулируя распад гликогена, способствует поддержанию глюкозы в крови на постоянном уровне.
Адреналин стимулирует выведение глюкозы из печени в кровь, для того чтобы снабдить ткани (в основном мозг и мышцы) "топливом" в экстремальной ситуации. Эффект адреналина в печени обусловлен фосфорилированием (и активацией) гликогенфосфорилазы. Адреналин имеет сходный с глюкагоном механизм действия (рис. 7-29). Но возможно включение и другой эффекторной системы передачи сигнала в клетку печени (рис. 7-30).
Какая система передачи сигнала в клетку будет использована, зависит от типа рецепторов, с
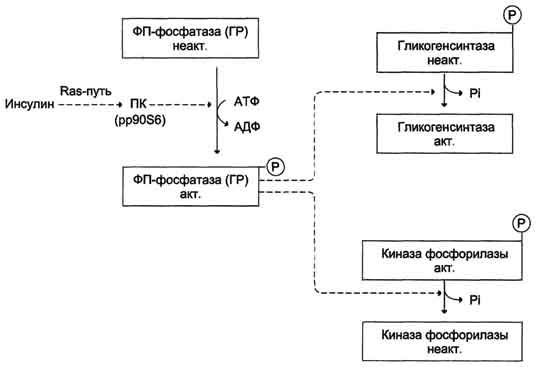
Рис. 7-28. Влияние инсулина на активность гликогенсинтазы и киназы фосфорилазы. ФП-фосфатаза (ГР) - фосфопроте-инфосфатаза гранул гликогена. ПК (pp90S6) - протеинкиназа, активируемая инсулином.
которыми взаимодействует адреналин. Так, взаимодействие адреналина с β2-рецепторами клеток печени приводит в действие аденилатциклазную систему. Взаимодействие же адреналина с α1-рецепторами "включают" инозитолфосфатный механизм трансмембранной передачи гормонального сигнала. Результат действия обеих систем - фосфорилирование ключевых ферментов и переключение процессов с синтеза гликогена на его распад. Следует отметить, что тип рецепторов, который в наибольшей степени вовлекается в ответ клетки на адреналин, зависит от концентрации его в крови.
В период пищеварения преобладает влияние инсулина, так как инсулинглюкагоновый индекс в этом случае повышается. В целом инсулин влияет на обмен гликогена противоположно глюкагону. Инсулин снижает концентрацию глюкозы в крови в период пищеварения, действуя на метаболизм печени следующим образом:
- снижает уровень цАМФ в клетках, фосфорилируя (опосредованно через Ras-путь) и тем самым активируя протеинкиназу В (цАМФ-независимую). Протеинкиназа В, в свою очередь, фосфорилирует и активирует фосфодиэстеразу цАМФ - фермент, гидролизующий цАМФ с образованием АМФ. Механизм влияния инсулина на уровень цАМФ в клетке подробнее будет изложен в разделе 11;
- активирует (через Ras-путь) фосфопротеинфосфатазу гранул гликогена, которая дефосфорилирует гликогенсинтазу и таким образом её активирует. Кроме того, фосфопротеинфосфатаза дефосфорилирует и, следовательно, инактивирует киназу фосфорилазы и гликогенфосфорилазу;
- индуцирует синтез глюкокиназы, тем самым ускоряя фосфорилирование глюкозы в клетке. Следует напомнить, что регуляторным фактором в метаболизме гликогена является также величина Кm глюкокиназы, которая много выше, чем Кm гексокиназы. Смысл этих различий понятен: печень не должна потреблять глюкозу для синтеза гликогена, если её количество в крови в пределах нормы.
Всё это вместе приводит к тому, что инсулин одновременно активирует гликогенсинтазу и ингибирует гликогенфосфорилазу, переключая процесс мобилизации гликогена на его синтез.

Рис. 7-29. Регуляция синтеза и распада гликогена в печени глюкагоном и адреналином. 1 - глюкагон и адреналин взаимодействуют со специфическими мембранными рецепторами. Комплекс гормон-рецептор влияет на конформацию G-белка, вызывая диссоциацию его на протомеры и замену в α-субъединице ГДФ на ГТФ; 2 - α-субъединица, связанная с ГТФ, активирует аденилатциклазу, катализирующую синтез цАМФ из АТФ; 3 - в присутствии цАМФ протеинкиназа А (цАМФ-зависимая) обратимо диссоциирует, освобождая обладающие каталитической активностью субъединицы С; 4 - протеинкиназа А фосфорилирует и активирует киназу фосфорилазы; 5 - киназа фосфорилазы фосфорилирует гликогенфосфорилазу, переводя её в активную форму; 6-протеинкиназа А фосфорилирует также гликогенсинтазу, переводя её в неактивное состояние; 7 - в результате ингибирования гликогенсинтазы и активации гликогенфосфорилазы гликоген включается в процесс распада; 8 - фосфодиэсте-раза катализирует распад цАМФ и тем самым прерывает действие гормонального сигнала. Комплекс ос-субъединица-ГТФ затем распадается, α-, β- и γ-субъединицы G-белка реассоциируются.
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 2827; Нарушение авторских прав?; Мы поможем в написании вашей работы!