
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Глюкозо-аланиновый цикл
|
|
|
|
имеется фермент глицерол киназа, например печень, почки. Этот АТФ-зависимый фермент катализирует превращение глицерола в α-глицерофосфат (глицерол-3-фосфат). При включении глицерол-3-фосфата в глюконеогенез происходит его дегидрирование NAD-зависимой дегидрогеназой с образованием дигидроксиацетонфосфата (рис. 7-53), который далее превращается в глюкозу.
343:: 344:: 345:: 346:: 347:: 348:: 349:: 350:: Содержание
350:: 351:: 352:: 353:: 354:: 355:: Содержание
X. РЕГУЛЯЦИЯ ГЛИКОЛИЗА И ГЛЮКОНЕОГЕНЕЗА В ПЕЧЕНИ
По сравнению с другими органами печень отличается наиболее сложным обменом глюкозы. Кроме пары противоположных процессов (синтеза и распада гликогена), в печени могут происходить ещё два противоположно направленных процесса - гликолиз и глюконеогенез. В большинстве других органов происходит только гликолиз. Переключение печени с гликолиза на глюконеогенез и обратно происходит с участием инсулина и глюкозагона и осуществляется с помощью:
- аллостерической регуляции активности ферментов;
- ковалентной модификации ферментов путём фосфорилирования/дефосфорилирования;
- индукции/репрессии синтеза ключевых ферментов.
Регуляторные воздействия направлены на ферменты, катализирующие необратимые стадии гликолиза и глюконеогенеза, сочетание которых называют "субстратными", или "холостыми" циклами.
А. Регуляция скорости реакции гликолиза и глюконеогенеза, составляющих субстратные циклы
"Субстратные" циклы - парные комбинации процессов синтеза и распада метаболитов. Как уже упоминалось, сочетание процессов синтеза и распада гликогена или необратимых реакций гликолиза и соответствующих им необратимых реакций глюконеогенеза может составить подобный цикл. Название "субстратный цикл" означает объединение реакций синтеза и распада субстрата. Название "холостой" отражает результат работы подобного цикла, заключающийся в бесполезном расходовании АТФ. Хотя существование "холостых" циклов нелогично, тем не менее они могут функционировать. Более того, эти циклы могут быть мишенью регуляторных воздействий, так как составляющие их реакции катализируют разные ферменты. Реципрокное изменение активности этих ферментов предотвращает одновременное протекание противоположных процессов.
Изменение в печени гликолитического направления на глюконеогенез и обратно при смене абсорбтивного состояния на постабсорбтивное или при голодании происходит главным образом в результате регуляции активности ферментов, катализирующих реакции субстратных циклов. Эти циклы обозначены цифрами I, II, III на рис. 7-54, представляющем общую картину регуляции гликолиза и глюконеогенеза в печени.
Направление реакции первого субстратного цикла регулируется главным образом концентрацией глюкозы. При пищеварении концентрация глюкозы в крови повышается (до 8-10 ммоль/л). Активность глюкокиназы в этих условиях максимальна. Вследствие этого ускоряется гликолитическая реакция образования глюкозо-6-фосфата. Кроме того, инсулин индуцирует синтез глюкокиназы и ускоряет тем самым фосфорилирование глюкозы. Поскольку глюкокиназа печени не ингибируется глюкозо-6-фосфатом (в отличие от гексокиназы мышц), то основная часть глюкозо-6-фосфата в абсорбтивном периоде направляется на синтез гликогена и по гликолитическому пути.
Направление реакций второго субстратного цикла зависит от активности фосфофруктокиназы и фосфатазы фруктозо-1,6-бисфосфата. Активность этих ферментов зависит от концентрации фруктозо-2,6-бисфосфата. Фруктозо-2,6-бисфосфат - метаболит, образующийся в незначительных количествах из фруктозо-6-фосфата и выполняющий только регуляторные функции. Образование фруктозо-2,6-бисфосфата путём фосфорилирования фруктозо-6-фосфата катализирует бифункциональный фермент (БИФ), который катализирует также и обратную реакцию (рис. 7-55, А). Однако превращение фруктозо-2,6-бисфосфата в фруктозо-6-фосфат не является обратимым процессом. Образование фруктозо-2,6-бисфосфата требует затрат АТФ, а при образовании фруктозо-6-фосфата из фруктозо-2,6-бисфосфата гидролитически отщепляется неорганический фосфат.
В реакции фосфорилирования фруктозо-6-фосфата фермент проявляет киназную активность, а при дефосфорилировании образованного фруктозо-2,6-бисфосфата - фосфатазную. Это обстоятельство и определило название фермента "бифункциональный".
Киназная активность БИФ проявляется, когда фермент находится в дефосфорилированной форме (БИФ-ОН). Дефосфорилированная форма БИФ характерна для абсорбтивного периода, когда инсулин/глюкагоновый индекс высокий. В этот период количество фруктозо-2,6-бисфосфата увеличивается (рис. 7-55, Б).
При низком инсулинглюкагоновом индексе, характерном для периода длительного голодания, происходит фосфорилирование БИФ, и он функционирует как фосфатаза. Результат - снижение количества фруктозо-2,6-бисфосфата.
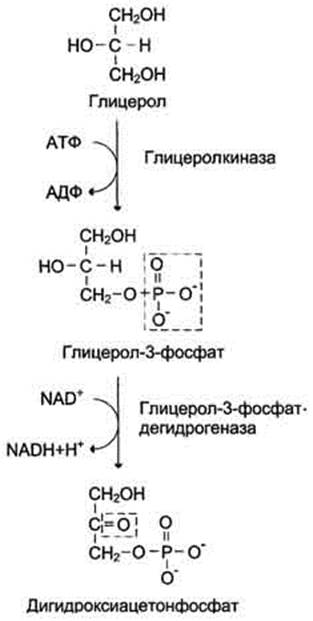
Рис. 7-53. Превращение глицерола в дигидроксиацетонфосфат.
Киназную и фосфатазную реакции катализируют разные активные центры БИФ, но в каждом из двух состояний фермента (фосфорилированном и дефосфорилированном) один из активных центров ингибирован. Регуляторное влияние фруктозо-2,6-бисфосфата заключается в том, что он аллостерически активирует фос-фофруктокиназу (фермент гликолиза). При этом фруктозо-2,6-бисфосфат снижает ингибирующее действие АТФ на этот фермент в абсорбтивном периоде и повышает его сродство к фруктозо-6-фосфату. В то же время фруктозо-2,6-бисфосфат ингибирует фруктозо-1,6-бисфосфатазу (фермент глюконеогенеза). Итак, в абсорбтивном периоде уровень фруктозо-2,6-бисфосфата повышается, что приводит к активации фосфофруктокиназы и ускорению гликолиза.
Результатом уменьшения количества фруктозо-2,6-бисфосфата в постабсорбтивном периоде
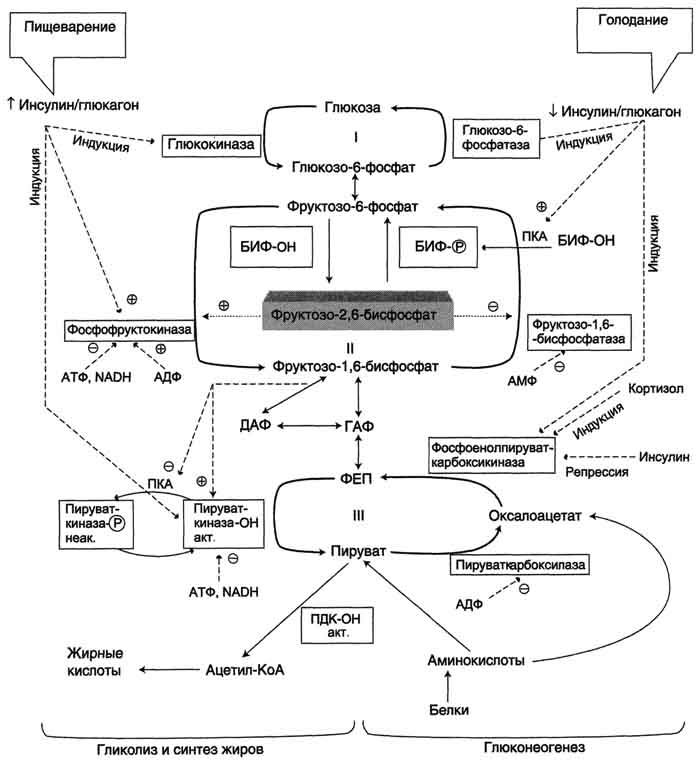
Рис. 7-54. Регуляция метаболизма глюкозы в печени. БИФ - бифункциональный фермент (фруктозо-2,6-бисфосфатаза/фос-фофруктокиназа-2); БИФ-ОН - дефосфорилированный фермент; БИФ-Р - фосфорилированный фермент, ПДК-ОН - дефосфорилированный пируватдегидрогеназный комплекс; ПК-ОН - дефосфорилированная пируваткиназа; ГАФ - глицеральдегидфосфат; ДАФ - дигидроксиацетонфосфат, ФЕП - фосфоенолпируват. I-III - субстратные циклы: в рамках - регупяторные ферменты глиполиза и глюконеогенеза.

Рис. 7-55. Реакции, катализируемые бифункциональным ферментом (БИФ) в печени (А). Регуляция активности БИФ (Б).
будет снижение активности фосфофруктокиназы, замедление гликолиза и переключение гликолиза на глюконеогенез. Регуляторное влияние фруктозо-2,6-бисфосфата представлено на рис. 7-56.
В регуляции третьего субстратного цикла основная роль принадлежит пируваткиназе, фосфорилированная форма которой неактивна, а дефосфорилированная - активна (рис. 7-57).
В период пищеварения инсулин активирует фосфопротеинфосфатазу, которая дефосфорилирует пируваткиназу, переводя её в активное состояние. Кроме того, инсулин в печени влияет на количество ферментов, индуцируя синтез пируваткиназы и репрессируя синтез фосфоенолпи-руваткарбоксикиназы. Следовательно, гликолитическая реакция фосфоенолпируват → пируват ускоряется при пищеварении. Эта же реакция замедляется в постабсорбтивном состоянии под влиянием глюкагона, который опосредованно через цАМФ-зависимую протеинкиназу фосфо-рилирует и инакгивирует пируваткиназу.
При длительном голодании глюкагон ускоряет глюконеогенез. Это достигается не только путём фосфорилирования пируваткиназы и снижением скорости гликолиза, но и путём индукции синтеза ферментов глюконеогенеза: фосфоенолпируваткарбоксикиназы, фруктозо-1,6-бисфосфатазы и глюкозо-6-фосфатазы. Известно, что глюкагон, фосфорилируя опосредованно транскрипционные факторы, влияет на их активность и таким образом индуцирует синтез этих ферментов глюконеогенеза. Кроме того, синтез фосфоенолпируваткарбоксикиназы при длительном голодании индуцируется кортизолом, однако это происходит в результате включения другого механизма действия, характерного для стероидных гормонов (см. разделы 5, 11).
Координация скорости реакции II и III субстратных циклов достигается с помощью фруктозо-1,6-бисфосфата - продукта II субстратного цикла (гликолитическое направление), который является аллостерическим активатором пируваткиназы. В период пищеварения вследствие ускорения начальных стадий гликолиза концентрация фруктозо-1,6-бисфосфата повышается, что приводит к дополнительной активации пируваткиназы.
Общая картина регуляции процессов, составляющих метаболизм глюкозы в печени, представлена на рис. 7-54.
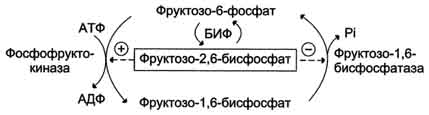
Рис. 7-56. Регуляция реакций II субстратного цикла фруктозо-2,6-бисфосфатом.

Рис. 7-57. Регуляция пируваткиназы в печени.
Необходимо отметить, что противоположные реакции каждого из субстратных циклов могут протекать одновременно. Соответственно, гликолиз и глюконеогенез в печени в какой-то мере тоже могут происходить одновременно, хотя их относительные скорости изменяются. Так, при пищеварении преобладает гликолитическое направление, а в постабсорбтивном состоянии - направление глюконеогенеза. Например, реакция глюконеогенеза пируват → оксалоацетат может протекать при любых состояниях организма. Это объясняется необходимостью поддерживать концентрацию оксалоацетата на определенном уровне, потому что оксалоацетат используется не только в глюконеогенезе, но и в других процессах, таких как цитратный цикл, трансмембранный перенос веществ, синтез аминокислот.
Б. Значение гликолиза в печени для синтеза жиров
Основным значением ускорения гликолиза в печени в период пищеварения является образование дигидроксиацетонфосфата и ацетил-
КоА - исходных веществ для синтеза жира. Образование ацетил-КоА из пирувата в ходе реакции, катализируемой ПДК, регулируется разными способами и подробно описывалось в разделе 6.
В абсорбтивном периоде ПДК находится в дефосфорилированной (активной) форме, следовательно, декарбоксилирование пирувата ускоряется. Образуемый ацетил-КоА используется в основном двумя путями: для синтеза жирных кислот и в цитратном цикле. В период пищеварения ускоряются образование ацетил-КоА и его использование для синтеза жирных кислот. Необходимый для синтеза жира α-глицерофосфат образуется в реакции восстановления из дигидроксиацетонфосфата (рис. 7-58). Подробно этот процесс рассматривается в разделе 8.
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 2221; Нарушение авторских прав?; Мы поможем в написании вашей работы!