
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
А. Фософорилирование глюкозы 2 страница
|
|
|
|

Рис.7-30. Регуляция синтеза и распада гликогена в печени адреналином и Са2+. ФИФ2- фосфатидилинозитолбисфосфат; ИФ3- инозитол-1,4,5-трифосфат; ДАГ - диацилглицерол; ЭР - эндоплазматический ретикулум; ФС - фосфодитилсерин. 1 - взаимодействие адреналина с α1-рецептором трансформирует сигнал через активацию G-белка на фосфолипазу С, переводя её в активное состояние; 2 - фосфолипаза С гидролизует ФИФ2 на ИФ3 и ДАГ; 3 - ИФ3 активирует мобилизацию Са2+ из ЭР; 4 - Са2+, ДАГ и фосфодитилсерин активируют протеинкиназу С. Протеинкиназа С фосфорилирует гликогенсинтазу, переводя её в неактивное состояние; 5 - комплекс 4Са2+-кальмодулин активирует киназу фосфорилазы и кальмодулин-зависимые протеинкиназы; 6 - киназа фосфорилазы фосфорилирует гликогенфосфорилазу и тем самым её активирует; 7 - активные формы трёх ферментов (кальмодулинзависимая протеинкиназа, киназа фосфорилазы и протеинкиназа С) фосфорилируют гликогенсинтазу в различных центрах, переводя её в неактивное состояние.
В печени существует и аллостерическая регуляция гликогенфосфорилазы, обеспечивающая внутриклеточные потребности в глюкозе, но гормональные сигналы имеют приоритет над внутриклеточными и преследуют другие физиологические цели. Ранее (см. раздел 6) рассматривалось значение изменения в клетке уровней АТФ, АДФ и АМФ как показателя, отражающего потребности клетки в энергии. Замедление утилизации АТФ сопровождается снижением активности гликогенфосфорилазы и уменьшением скорости распада гликогена. Напротив, увеличение расходования АТФ ведёт к повышению уровня АМФ, активации гликогенфосфорилазы и ускорению распада гликогена. АТФ и АМФ являются аллостерическими эффекторами по отношению к гликогенфосфорилазе. Существует также и метаболический контроль активности гликогенфосфорилазы. Так, при повышении концентрации глюкозо-6-фосфата активность этого фермента в клетках печени снижается.
Г. Регуляция метаболизма глиогена в мышцах
Регуляция обмена гликогена в мышцах обеспечивает энергетическим материалом как интенсивную работу мышц (бег или борьба), так и энергозатраты в состоянии покоя.
В экстремальных ситуациях в мышечных клетках мобилизация гликогена ускоряется адреналином. Связывание адреналина с β-рецептора-ми, ассоциированными с аденилатциклазной системой, приводит к образованию цАМФ в клетке, а затем фосфорилированию и активации киназы фосфорилазы и гликогенфосфорилазы (рис. 7-31).
Образование цАМФ, стимулированное адреналином, служит сигналом к увеличению производства энергии в результате ускорения расщепления гликогена. Именно в ходе распада, образованного из гликогена глюкозо-6-фосфата, синтезируется АТФ.
Инактивация гликогенсинтазы под влиянием адреналина в мышечных клетках проходит так же, как и в печени.
В состоянии покоя при низких концентрациях адреналина в крови гликогенфосфорилаза мышц находится в дефосфорилированном - неактивном состоянии (форма В), но распад гликогена всё-таки происходит. Это объясняется тем, что гликогенфосфорилаза активируется способом, не связанным с её фосфорилированием, так как уровень цАМФ в клетке низкий. В данной ситуации происходит аллостерическая активация гликогенфосфорилазы В. Активаторами фермента служат АМФ и Н3РО4, образующиеся в клетке при распаде АТФ (рис. 7-31, путь 1).
При умеренных мышечных сокращениях, т.е. в ситуации, не требующей участия в регуляции цАМФ, аллостерическим способом активируется киназа фосфорилазы (рис. 7-31, путь 2). В данном случае аллостерическими эффекторами служат ионы Са2+, концентрация которых резко возрастает при сокращении мышц в ответ на сигнал от двигательного нерва. Активность фермента снижается сразу же, как только концентрация Са2+ в клетке уменьшается после поступления сигнала к расслаблению мышц. Таким образом, роль ионов Са2+ заключается не только в инициации мышечного сокращения, но также в обеспечении его энергозатрат.
Активация киназы фосфорилазы с помощью ионов Са2+ опосредована кальмодулином. Каль-модулин в данном случае - прочно связанная субъединица фермента (рис. 7-32). Мышечная киназа фосфорилазы состоит из субъединиц 4 типов: α, β, γ и δ, объединённых в комплекс. Фермент включает 4 таких комплекса. Каталитической активностью обладает γ-субъединица. Субъединицы аир выполняют регуляторную функцию. Они содержат остатки серина, фосфорилируемые ПК А. δ-Субъединица связывает 4 иона кальция; она идентична белку кальмодулину. Связывание ионов кальция вызывает конформационные изменения, что приводит к активации каталитического центра γ-субъединицы, хотя молекула остаётся в дефосфорилированном состоянии.
В мышцах в период пищеварения, если он совпадает с состоянием покоя, происходит стимуляция синтеза гликогена. Мышечная работа во время пищеварения замедляет процесс синтеза гликогена, так как при этом мышцы используют для окисления глюкозу крови, поступающую из кишечника.
В переключении мобилизации гликогена на запасание глюкозы участвует инсулин. Как уже говорилось, глюкоза поступает в мышечные и жировые клетки с помощью глюкозо-транспортёров ГЛЮТ-4. Транспортёры в отсутствие инсулина находятся в цитоплазме клеток, и глюкоза клетками не используется, так как в мембране
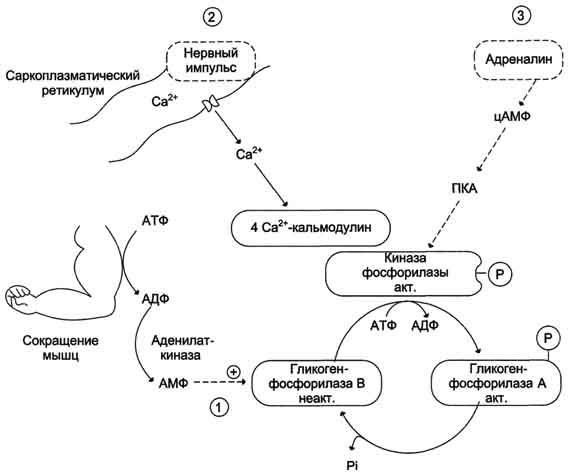
Рис. 7-31. Активация гликогенфосфорилазы мышц. 1 - аллостерическая активация гликогенфосфорилазы В. В процессе мышечного сокращения происходит разрушение АТФ с образованием АМФ, который является аллостерическим активатором гликогенфосфорилазы В; 2 - нервный импульс инициирует освобождение Ca2+ из саркоплазматического ретикулума. Са2+ образует комплекс с кальмодулином, способный активировать киназу фосфорилазы; 3 - активация гликогенфосфорилазы адреналином через аденилатциклазную систему.
нет белков-переносчиков. Инсулин стимулирует перемещение ГЛЮТ-4 и встраивание их в мембрану клеток. Механизм подобного влияния инсулина изучен недостаточно, но определены его основные этапы. Цепь событий при стимуляции инсулином потребления глюкозы мышцами и жировыми клетками выглядит следующим образом:
- рецептор инсулина (IR) - инсулинстимулируемая тирозиновая протеинкиназа - обязательный посредник всех действий инсулина (см. раздел 5);
- активированный инсулином IR фосфорилирует специфические цитоплазматические белки - субстраты инсулина (IRS);
- фосфорилированный субстрат (в основном IRS-1) соединяется с фосфатидилинозитол-3-киназой (ФИ-3-киназа) и активирует этот фермент;
- активная ФИ-3-киназа катализирует фосфорилирование по позиции 3 ряд компонентов инозитолфосфатной сигнальной системы, приводящей к стимуляции транслокации ГЛЮТ из цитозоля в плазматическую мембрану;
- глюкоза с помощью ГЛЮТ-4 поступает в мышечные клетки и включается в синтез гликогена.
Влияние инсулина на скорость синтеза гликогена в мышцах осуществляется посредством изменения активности гликогенсинтазы и гликогенфосфорилазы - ключевых ферментов, о чём уже говорилось при обсуждении влияния инсулина на метаболизм гликогена в печени.

Рис. 7-32. Регуляция активности киназы фосфорилазы. Фермент состоит из 4 идентичных белковых комплексов. Каждый комплекс содержит 4 разных субъединицы α, β, γ, δ. На рисунке показан один из тетрамеров. Каталитической активностью обладает γ-субъединица. α- и β- протомеры выполняют регуляторную функцию, они фосфорилируются при участии ПК А. Каль-модулин - δ-субъединица, прочно связанная с ферментом. А - активация киназы фосфорилазы в результате фосфорилирования; Б - активация киназы фосфорилазы после присоединения Са2+ к кальмодулину.
Д. Нарушения обмена гликогена
Гликогеновые болезни -группа наследственных нарушений, в основе которых лежит снижение или отсутствие активности ферментов, катализирующих реакции синтеза или распада гликогена, либо нарушение регуляции этих ферментов.
1. Гликогенозы - заболевания, обусловленные дефектом ферментов, участвующих в распаде гликогена. Они проявляются или необычной структурой гликогена, или его избыточным накоплением в печени, сердечной или скелетных мышцах, почках, лёгких и других органах. В таблице 7-3 описаны некоторые типы гликогенозов, различающихся характером и локализацией ферментного дефекта.
Следует отметить, что термин "гликогеноз" был впервые предложен К.Ф. Кори и Г.Т. Кори. Они же предложили систему нумерации этих болезней. Однако в настоящее время преобладает деление гликогенозов на 2 группы: печёночные и мышечные.
· Печёночные формы гликогенозов ведут к нарушению использования гликогена для поддержания уровня глюкозы в крови. Поэтому общий симптом для этих форм - гипогликемия в постабсорбтивный период.
· Болезнь Гирке (тип I) отмечаютнаиболее часто. Описание основных симптомов этого типа гликогеноза и их причин может служить основанием для понимания симптомов всех остальных типов. Причина этого заболевания - наследственный дефект глюкозо-6-фосфатазы - фермента, обеспечивающего выход глюкозы в кровоток после её высвобождения из гликогена клеток печени. Болезнь Гирке проявляется гипогликемией, гипертриацилглицеролемией (повышением содержания триацилглицеролов), гиперурикемией (повышением содержания мочевой кислоты).
· Гипогликемия - следствие нарушения реакции образования свободной глюкозы из глюкозо-6-фосфата. Кроме того, вследствие дефекта глюкозо-6-фосфатазы происходит
Таблица 7-3. Характеристика некоторых гликогеновых болезней
| Гликогенозы | |||
| форма гликогеноза | дефектный фермент | проявления болезни | тип, название болезни |
| Печёночная | Глюкозо-6-фосфатаза | Гипогликемия, гиперацилглицеролемия, гиперурикемия, ацидоз (вследствие накопления лактата), характерное выражение лица («лицо китайской куклы»). | I Болезнь Гирке |
| Амило- 1,6-глюкозидаза («деветвящий» фермент) | Накопление гликогена с короткими внешними ветвями (лимито-декстрин). Остальные проявления менее выражены, чем при типе I. | III Болезнь Форбса-Кори, лимито-декстриноз | |
| Амило- 1,4 → 1,6 глюкозилтрансфераза («ветвящий» фермент) | Накопление структурно изменённого гликогена с очень длинными наружными ветвями и редкими точками ветвления. | IV Болезнь Андерсена | |
| Фосфорилаза | Накопление гликогена нормальной структуры. Умеренная гипогликемия, гепатомегалия, клинические проявления похожи, но менее выражены, чем при гликогенозах I и III типов. | VI Болезнь Херса | |
| Киназа фосфорилазы | Аналогичны VI типу | IX | |
| Протеинкиназа А | Аналогичны VI типу | X | |
| Мышечные | Гликогенфосфорилаза | Боли в мышцах, судороги при физической нагрузке (даже умеренной). Накопление в мышцах гликогена нормальной структуры. | V Болезнь МакАрдла |
| Фосфофруктокиназа | Аналогичны V типу | VII | |
| Фосфоглицеромутаза | Аналогичны V типу | ||
| Лактатдегидрогеназа (М-протомер) | Аналогичны V типу | ||
| Смешанные | Лизосомная α-1,4-гликозидаза | Генерализованное накопление гликогена в лизосомах, а затем в цитозоле | II Болезнь Помпе |
накопление в клетках печени субстрата - глюкозо-6-фосфата, который вовлекается в процесс катаболизма, где он превращается в пируват и лактат. В крови повышается количество лактата, поэтому возможен ацидоз. В тяжёлых случаях результатом гипогликемии могут быть судороги. Гипогликемия сопровождается уменьшением содержания инсулина и снижением отношения инсулин/глюкагон, что, в свою очередь, ведёт к ускорению липолиза жировой ткани в результате действия глюкагона и выходу в кровь жирных кислот (см. раздел 8).
· Гипертриацилглицеролемия возникает в результате снижения активности ЛП-липазы жировой ткани - фермента, активируемого инсулином и обеспечивающего усвоение ТАГ клетками жировой ткани (см. раздел 8).
· Гиперурикемия возникает в результате следующих событий:
· увеличиваются содержание в клетках глюкозо-6-фосфата и его использование в пентозофосфатном пути с образованием рибозо-5-фосфата - субстрата для синтеза пуриновых нуклеотидов;
· увеличивается образование мочевой кислоты вследствие избыточного синтеза, а следовательно, и катаболизма пуриновых нуклеотидов, конечным продуктом которого является мочевая кислота.
· снижается выведение мочевой кислоты вследствие увеличения продукции лактата и изменения рН мочи в кислую сторону, что затрудняет выведение уратов - труднорастворимых солей мочевой кислоты.
· При диагностике данной патологии определяют активность глюкозо-6-фосфатазы в био-птатах печени. Кроме того, используют тест со стимуляцией глюкагоном или адреналином, который в случае болезни даёт отрицательный результат, т.е. после инъекции гормона уровень глюкозы в крови изменяется незначительно.
· Лечение состоит в ограничении употребления продуктов, содержащих глюкозу. Рекомендуется исключить из диеты продукты, содержащие сахарозу и лактозу, так как образующиеся из них галактоза и фруктоза после превращения в глюкозо-6-фосфат ведут к дальнейшему накоплению гликогена. Для предотвращения гипогликемии используют метод частого кормления. Этим можно предупредить симптомы гипогликемии.
· Гликогеноз I типа наследуется по аутосомно-рецессивному типу. Уже в раннем периоде наиболее заметный признак - гепатомегалия. У больных детей короткое туловище, большой живот, увеличены почки. Больные дети отстают в физическом развитии.
· Описанное заболевание иногда обозначают как гликогеноз типа Iа, так как существует его разновидность - тип Ib. Гликогеноз Ib представляет собой редко встречающуюся патологию, которая характеризуется тем, что дефектен фермент транслоказа глюкозо-6-фосфата, обеспечивающий транспорт фос-форилированной глюкозы в ЭР. Поэтому, несмотря на достаточную активность глюкозо-6-фосфатазы, отщепление неорганического фосфата и выход глюкозы в кровь нарушен. Клиническая картина гликогеноза типа Ib такая же, как при гликогенозе Iа.
· Болезнь Кори (тип III) весьма распространена. Она составляет 1/4 всех случаев печёночных гликогенозов. Накапливаемый гликоген аномален по структуре, так как дефектен фермент амило-1,6-глюкозидаза, гидролизующий гликозидные связи в местах разветвлений ("деветвящий фермент", от англ, debmnching enzyme). Недостаток глюкозы в крови проявляется быстро, поскольку гликогенолиз возможен, но в незначительном объёме. В отличие от гликогеноза I типа, лактоацидоз и гиперурикемия не отмечаются. Болезнь отличается более лёгким течением.
· Болезнь Андерсен (тип IV) -крайне редкое аутосомно-рецессивное заболевание, возникающее вследствие дефекта ветвящего фермента - амило-1,4-1,6-глюкозилтрансферазы. Содержание гликогена в печени не сильно увеличено, но структура его изменена, и это препятствует его распаду. Молекула гликогена имеет мало точек ветвления, а также очень длинные и редкие боковые ветви. В то же время гипогликемия выражена умеренно. Болезнь развивается быстро, отягощается ранним циррозом печени и практически не поддаётся лечению. Дефект фермента ветвления обнаруживается не только в печени, но также в лейкоцитах, мышцах, фибробластах, на ранние и преобладающие проявления болезни обусловлены нарушением функции печени.
· Болезнь Херса (тип VI) также проявляется симптомами, обусловленными поражением печени. Данный гликогеноз - следствие дефекта гликогенфосфорилазы. Б гепатоцитах накапливается гликоген нормальной структуры. Течение болезни сходно с гликогенозом I типа, но симптомы выражены в меньшей степени. Сниженная активность гликогенфосфорилазы обнаруживается также в лейкоцитах. Болезнь Херса - редкий тип гликогеноза; наследуется по аутосомнорецессивному типу.
· Дефект киназы фосфорилазы (тип IX) встречается только у мальчиков, так как этот признак сцеплен с Х-хромосомой.
· Дефект протеинкиназы А (тип X), так же как и дефект киназы фосфорилазы, проявляется симптомами, сходными с болезнью Херса.
· Мышечные формы гликогенозов характеризуются нарушением в энергоснабжении скелетных мышц. Эти болезни проявляются при физических нагрузках и сопровождаются болями и судорогами в мышцах, слабостью и быстрой утомляемостью.
· Болезнь МакАрдла (тип V) - аутосомнорецессивная патология, при которой полностью отсутствует в скелетных мышцах активность гликогенфосфорилазы. Поскольку активность этого фермента в гепатоцитах нормальная, то гипогликемия не наблюдается (строение фермента в печени и мышцах кодируются разными генами). Тяжёлые физические нагрузки плохо переносятся и могут сопровождаться судорогами, однако при физических нагрузках гиперпродукция лактата не наблюдается, что подчёркивает значение внемышечных источников энергии для сокращения мышц, например, таких как жирные кислоты, замещающие при данной патологии глюкозу (см. раздел 8). Хотя болезнь не сцеплена с полом, большая частота заболевания характерна для мужчин.
· Дефект фосфофруктокиназы характерен для гликогеноза VII типа. Больные могут выполнять умеренные физические нагрузки. Течение болезни сходно с гликогенозом V типа, но основные проявления менее выражены.
· Дефект фосфоглщеромугазы и дефект М-субъединицы ЛДГ (ненумерованные по классификации Кори, см. табл. 7-3) характерны для мышечных форм гликогенозов. Проявления этих патологий аналогичны болезни МакАрдла. Дефект фосфоглицеромутазы в мышцах описан только у одного больного.
2. Агликогенозы
Агликогеноз (гликогеноз 0 по классификации) - заболевание, возникающее в результате дефекта гликогенсинтазы. В печени и других тканях больных наблюдают очень низкое содержание гликогена. Это проявляется резко выраженной гипогликемией в постабсорбтивном периоде. Характерный симптом - судороги, проявляющиеся особенно по утрам. Болезнь совместима с жизнью, но больные дети нуждаются в частом кормлении.
322:: 323:: 324:: 325:: 326:: 327:: 328:: 329:: 330:: 331:: 332:: 333:: Содержание
333:: 334:: 335:: 336:: 337:: 338:: 339:: 340:: 341:: 342:: 343:: Содержание
VIII. КАТАБОЛИЗМ ГЛЮКОЗЫ
Катаболизм глюкозы - основной поставщик энергии для процессов жизнедеятельности организма.
А. Основные пути катаболизма глюкозы
Окисление глюкозы до СО2 и Н2О (аэробный распад). Аэробный распад глюкозы можно выразить суммарным уравнением:
С6Н12О6 + 6 О2 → 6 СО2 + Н2О + 2820 кДж/моль.
Этот процесс включает несколько стадий (рис. 7-33).
- Аэробный гликолиз - процесс окисления глюкозы с образованием двух молекул пирувата;
- Общий путь катаболизма, включающий превращение пирувата в ацетил-КоА и его дальнейшее окисление в цитратом цикле;
- ЦПЭ на кислород, сопряжённая с реакциями дегидрирования, происходящими в процессе распада глюкозы.
В определённых ситуациях обеспечение кислородом тканей может не соответствовать их потребностям. Например, на начальных стадиях интенсивной мышечной работы при стрессе сердечные сокращения могут не достигать нужной частоты, а потребности мышц в кислороде для аэробного распада глюкозы велики. В подобных случаях включается процесс, который протекает без кислорода и заканчивается образованием лактата из пировиноградной кислоты. Этот процесс
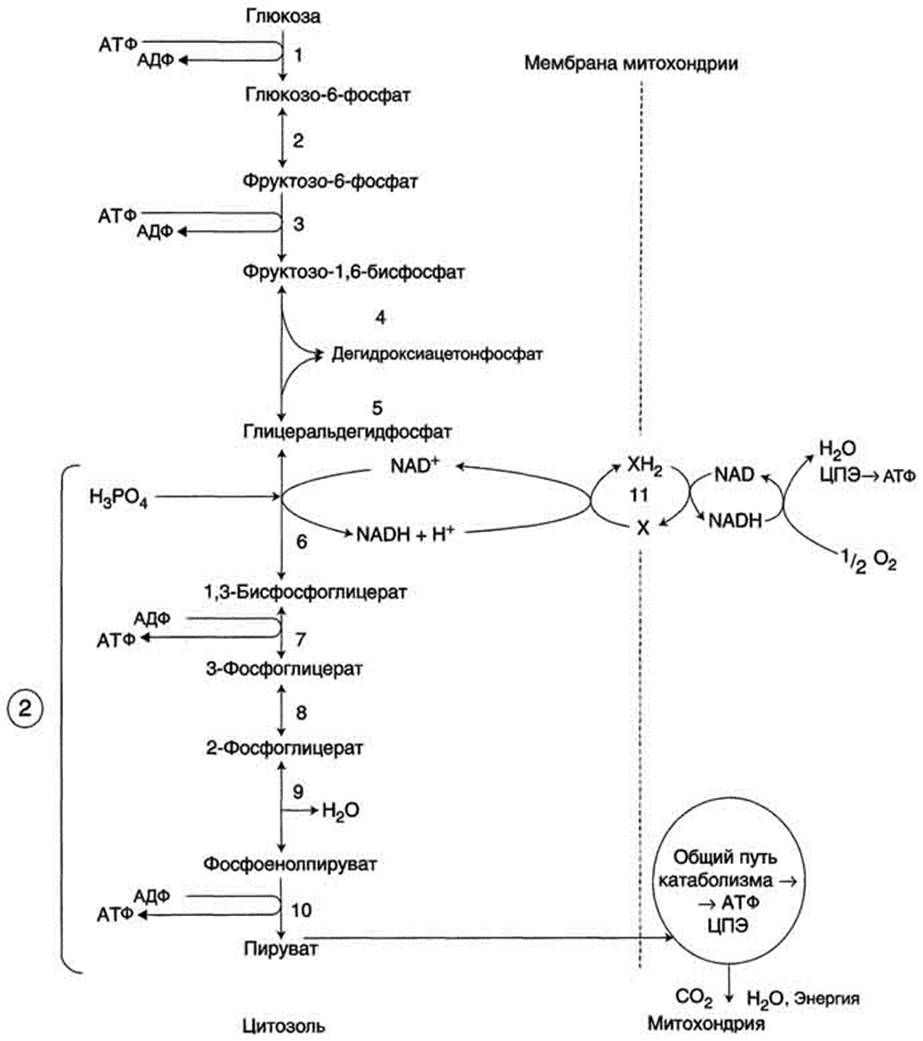
Рис. 7-33. Аэробный распад глюкозы. 1-10- реакции аэробного гликолиза; 11 - малат-аспартатный челночный механизм транспорта водорода в митохондрии; 2 (в кружке) - стехиометрический коэффициент.
называют анаэробным распадом, или анаэробным гликолизом. Анаэробный распад глюкозы энергетически малоэффективен, но именно этот процесс может стать единственным источником энергии для мышечной клетки в описанной ситуации. В даньнейшем, когда снабжение мышц кислородом будет достаточным в результате перехода сердца на ускоренный ритм, анаэробный распад переключается на аэробный. Пути катаболизма глюкозы и их энергетический эффект показаны на рис. 7-34.
Б. Аэробный гликолиз
Аэробным гликолизом называют процесс окисления глюкозы до пировиноградной кислоты, протекающий в присутствии кислорода. Все ферменты, катализирующие реакции этого процесса, локализованы в цитозоле клетки.
1. Этапы аэробного гликолиза
В аэробном гликолизе можно выделить 2 этапа.
- Подготовительный этап, в ходе которого глюкоза фосфорилируется и расщепляется на две молекулы фосфотриоз. Эта серия реакций протекает с использованием 2 молекул АТФ.
- Этап, сопряжённый с синтезом АТФ. В результате этой серии реакций фосфотриозы превращаются в пируват. Энергия, высвобождающаяся на этом этапе, используется для синтеза 10 моль АТФ.
2. Реакции аэробного гликолиза
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 1033; Нарушение авторских прав?; Мы поможем в написании вашей работы!