
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Утворення кінцевих продуктів білкового обміну
|
|
|
|
В результаті розпаду амінокислот утворюються С02, NH3, аміни, кетокислоти і у ряді випадків ще досить складні речовини, що відносяться до тих або інших класів органічних сполук. Всі вони, за винятком С02 і NH3, піддаються врешті-решт подальшій деструкції.
Аміни шляхом окислювального дезамінування перетворюються на карбонові кислоти:

Аналогічно йде реакція окислювального дезамінування диамінів за допомогою диаміноксидази.
Кетокислоти і карбонові кислоти, що виникають в результаті розпаду амінокислот, поступово окислюються, утворюючи С02 і Н20.
Внаслідок процесів переамінування і дезамінування амінокислот утворюються переважно такі a-кетокислоти, як піровиноградна і a-кетоглутарова.
Шляхи перетворення кожної з 20 амінокислот дещо різні, але фрагменти вуглецевого кістяка всіх амінокислот включаються в цикл трикарбонових кислот:
 | |||
|
Включення продуктів розщеплення амінокислот у цикл трикарбонових кислот відбувається в основному через ацетил-КоА. Цим шляхом вступає в цикл 13 амінокислот; 5 з них перетворюються в ацетил-КоА через піровиноградну кислоту; 5 – через ацетоацетил-КоА. Інші амінокислоти перетворюються на сполуки, які є проміжними в циклі трикарбонових кислот.
Наприклад, такі амінокислоти, як аргінін, гістидин, глутамін, пролін, через ряд хімічних перетворень утворюють глутамат, який внаслідок реакції трансамінування утворює a-кетоглутарову кислоту.
В циклі трикарбонових кислот відбувається аеробне окислення ацетильного залишку до СО2 і Н2О з виділенням енергії, що використовується організмом для біосинтетичних процесів.
Так само у С02, NH3 і Н20 перетворюються всі інші органічні речовини, що є продуктами розпаду амінокислот в організмі.
Таким чином, кінцевими продуктами розпаду амінокислот є Н20, С02 і NH3. Вода поступає до загального метаболічного фонду, оксид вуглецю (IV) безперешкодно виводиться з організму і тільки аміак піддається специфічним перетворенням.
Для людини та тварин вільний аміак є сильно токсичною речовиною, особливо для центральної нервової системи, тому концентрація аміаку в крові і тканинах суворо контролюється. Аміак відразу зв’язується з утворенням нетоксичних для організму сполук.
Лише, у деяких мешканців гідросфери (медична п'явка, краби, річковий рак, беззубка, каракатиця і ін.) NH3 безпосередньо або у вигляді солей амонію виводиться в навколишнє середовище.
У переважної більшості рослинних і тваринних видів аміак перетворюється в нешкідливі для біологічних форм азотисті сполуки. До їх числа належать аспарагін, глутамін і сечовина. У багатьох тварин, особливо хребетних, остання служить для виведення знешкоджуваного аміаку.
[1]. Один із шляхів швидкого знешкодження аміаку є приєднання його до глутамінової, а інколи до аспарагінової кислоти, внаслідок чого утворюються аміди — аспарагін і глутамін
Вважають, що аспарагінова і глутамінова кислоти здійснюють первинне зв’язування NH3 у момент його утворення в клітині.
Взаємодія аміаку з цими кислотами прискорюється специфічними ферментами. Обидва ферменти — аспарагінсинтетаза і глутамінсинтетаза — належать до класу лігаз, зокрема до підкласу лігаз, що прискорюють реакції утворення С—N-зв’язків, і серед них — до підпідкласу кислотоаміачних лігаз (амідосинтетази).
Оскільки необхідною умовою дії лігаз є пов’язаний з реакцією синтезу процес розпаду АТФ, то рівняння реакції біосинтезу аспарагіну має такий вигляд:
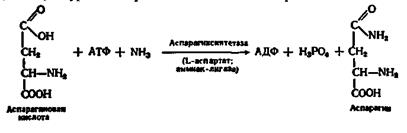
Аналогічно йде реакція біосинтезу глутаміну за участю глутамінсинтетази (L-глутамат:аміак-лігаза):
 |
Реакції утворення аспарагіну і глутаміну особливо широко представлені у рослин. Проте і у тварин ці аміди виникають не настільки рідко. У тканинах ссавців синтез аспарагіну йде з глутаміну, амідна група якого переноситься на g-карбоксильну групу аспарагінової кислоти за участю глутамінзалежної аспарагінсинтетази пов’язаний з розпадом АТФ до АМФ і пірофосфату.
Амідування аспарагінової і глутамінової кислот може відбуватися і в тому випадку, якщо вони знаходяться в зв'язаному стані, наприклад, у складі білкової молекули. Як відомо, радикали амінокислот, що входять у поліпептидний ланцюг білка, вільні і за ними легко здійснюються ті або інші хімічні реакції. Однією з таких реакцій є амідування білків:

Отже, не лише вільні аспарагінова і глутамінова кислоти, але і білки організму можуть бути акцепторами NH3. Тим самим забезпечується негайне зв’язування аміаку в будь-якому місці, де він виникає в результаті обміну речовин.
[2]. Більшість організмів здатні використовувати аміак, що утворюється внаслідок катаболізму амінокислот, для синтезу нових амінокислот. Це відбувається за рахунок реакції, яка каталізується глутаматдегідрогеназою.
[3]. Аміногрупи амінокислот використовуються також для біосинтезу пуринових і піримідинових основ нуклеїнових кислот.
[4]. Деяка частина утвореного аміаку залишається невикористаною і в кінці виводиться із організму тварин у формі сечовини, сечової кислоти або у вільному вигляді. Організм ссавців і людини виводить аміак амінокислот в основному у вигляді сечовини. Процес утворення сечовини складається з ряду ферментативних реакцій, що утворюють цикл сечовини.
Орнітиновий цикл (цикл сечовини)
 1. На першому етапі аміак реагує з СО2 з утворенням карбамоїлфосфату. Для синтезу цієї сполуки в організмі ссавців витрачається дві молекули АТФ. Ця реакція каталізується ферментом карбамоїлфосфатсинтетазою:
1. На першому етапі аміак реагує з СО2 з утворенням карбамоїлфосфату. Для синтезу цієї сполуки в організмі ссавців витрачається дві молекули АТФ. Ця реакція каталізується ферментом карбамоїлфосфатсинтетазою:
 2. На наступному етапі карбамоїлфосфат реагує з орнітином, віддаючи йому карбонільну групу. Внаслідок реакції, що каталізується ферментом орнітинтранскарбамоїлазою, утворюються цитрулін і фосфорна кислота;
2. На наступному етапі карбамоїлфосфат реагує з орнітином, віддаючи йому карбонільну групу. Внаслідок реакції, що каталізується ферментом орнітинтранскарбамоїлазою, утворюються цитрулін і фосфорна кислота;
3. Другою аміногрупою, що вступає в цикл сечовини, є аміногрупа аспарагінової кислоти, яка може утворюватися з глутамінової в результаті реакції трансамінування зщавлево-оцтовою кислотою. Аміногрупа аспарагінової кислоти конденсується з карбонільним атомом вуглецю молекули цитруліну за рахунок енергії АТФ. Внаслідок реакції утворюється аргініноянтарна кислота (аргініносукцинат); ця реакція каталізується ферментом аргініносукцинат-синтетазою:
 |
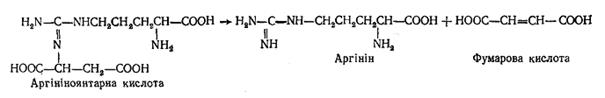 4. Далі аргініноянтарна кислота ферментативно розщеплюється під дією аргініносукцинатліази з утворенням аргініну і фумарової кислоти
4. Далі аргініноянтарна кислота ферментативно розщеплюється під дією аргініносукцинатліази з утворенням аргініну і фумарової кислоти
5. Фумарова кислота перетворюється в циклі трикарбонових кислот. За допомогою попередніх реакцій у клітинах синтезується амінокислота аргінін. В організмі ссавців і людини є фермент аргіназа, що каталізує реакцію відщеплення сечовини від аргініну з регенерацією орнітину:
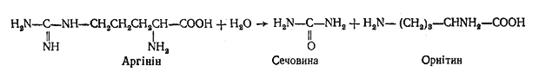 |
Орнітин знову може включитись в орнітиновий цикл.
Отже, сумарне рівняння циклу сечовини має вигляд:
2NH3 + CO2 + 3ATФ + 3H2O Þ H2N – CO – NH2 + 2AДФ + 2H3PO4 + АМФ + H4P2O7
Оскільки пірофосфат гідролізується до фосфату, то на утворення однієї молекули сечовини витрачається чотири високоенергетичних фосфатних зв'язків АТФ.
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 3219; Нарушение авторских прав?; Мы поможем в написании вашей работы!