
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
NB! Регуляция обмена гликогена органоспецифична
|
|
|
|
Гликоген находится в цитозоле вместе с ферментами, его синтезирующими и разрушающими, поэтому существует большая вероятность возникновения замкнутого круга метаболизма, при котором продукты распада гликогена тотчас же будут использоваться на его синтез и требуется тонкая регуляция взаимоотношений участников этих процессов. Основными регулируемыми ферментами являются гликогенсинтаза и фосфорилаза. Каждый их этих ферментов может находиться в двух конформационных состояних: активном (R, расслабленном) и неактивном (Т, напряженном) и регуляторы поддерживают эти состояние реципрокно. Если один из ферментов находится в R-конформации, то другой – в Т и наоборот. У каждого из ферментов имеются свои аллостерические регуляторы, а также важное место в их регуляции принадлежит ковалентной модификации структуры.
Гликогенфофорилаза представляет гомодимер с молекулярной массой 97 кДа. В образовании активного центра участвуют обе субъединицы. Важную роль в катализе фосфоролиза гликогена играет фосфопиридоксаль, который ковалентно связан с лизином активного центра.
Гликоген в печени и мышцах используется по-разному, и это сказывается на принципах регуляции активности фосфорилазы в этих органах. Мышечная фосфорилаза может находиться в двух формах фосфорилированной (R-форма, фосфорилаза а) и дефосфорилированной (Т-форма, фосфорилаза b). Переход одной формы в другую катализируется ферментом киназой фосфорилазы, которая фосфорилирует серин фосфорилазы. В покоящейся мышце преобладает фосфорилаза b.
Аллостерические регуляторы мышечной фосфорилазы АМФ и АТФ. Они связываются со специальным нуклеотидсвязывающим центром. Связывание с АМФ переводит фосфорилазу b в активную R-конформацию, а с АТФ – в Т-конформацию. Глюкозо-6-фосфат также стабилизирует Т-конформацию. Печеночная фосфорилаза не чувствительна к действию АМФ, но активность фосфорилазы а ингибируется глюкозой, что важно при регуляции уровня сахара в крови, источником которой служит гликоген печени.
Гликогенсинтаза также может находится в двух конформационных состояниях: гликогенсинтаза b –неактивная, ингибируется по аллостерическому механизму АТФ,АДФ, и гликогенсинтаза а –активная, активируется глюкозо-6-фосфатом.
Ковалентная модификация ведущих ферментов обмена гликогена выражается в цикле “фосфорилирование-дефосфориилрование”. Эти процессы катализируются специальными протеинкиназами, которые составляют часть каскадных механизмов действия гормонов на клетки.
Фосфорилирование гликогенфосфорилазы происходит при участии киназы фосфорилазы. Это сложный фермент с молекулярной массой 1200 кДа, состоящий из четырех типов субъединиц:
- 4 a субъединицы - каталитические субъединицы;
- 4 b субъединицы – регуляторные субъединицы, фосфорилируются протеинкиназой А и при этом активируются;
- 4 g субъединицы и
- 4 d субъединицы представлены кальмодулином – белком, связывающим Ca2+ и активирующим данную киназу.
Такое строение фермента показывает, что киназа фосфорилазы является ферментом, активность которого изменяется под влиянием вторичных посредников, образующихся в каскадных механизмах усиления нескольких гормонов (инсулина, адреналина и глюкагона).
Дефосфорилирование гликогенфосфорилазы и киназы фосфорилазы катализируется фосфопротеинфосфатазой 1, которая переводит эти ферменты в неактивное (напряженное) состяние. Фосфопротеинфосфатаза 1 состоит из трех субъединиц:
- каталитической субъединицы;
- G1-субъединицы, которая связывает гликоген и
- ингибитора 1, который в фосфорилированной форме тормозит активность протеинфосфатазы.
Фосфорилирование гликогенсинтазы вызывает ее ингибирование и катализируется рядом протеинкиназ, связанных с каскадами действия гормонов: кальмодулинзависимой протеинкиназой, протеинкиназой С, киназой-3 гликогенсинтазы.
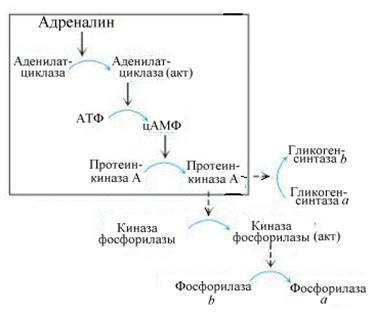
Рис. 5.7. Гормональный контроль гликогенолиза и гликогенеза
Адреналин и глюкагон, активируя аденилатциклазу, способствуют образованию цАМФ, который запускает “каскадный” механизм фосфорилирования ферментов распада и синтеза гликогена. В результате фосфорилирования образуется фосфорилированная, т.е. активная гликогенфосфорилаза и фосфорилированная, т.е. неактивная гликогенсинтаза. В этих условиях будет осуществляться распад гликогена (рис.5.7).
Напротив, под действием инсулина, включающего механизм дефосфорилирования ключевых ферментов, появятся дефосфорилированная, т.е. неактивная гликогенфосфорилаза, и дефосфорилированная, т.е. активная, гликогенсинтаза. В этих условиях будет происходить синтез гликогена.
Активность обоих ключевых ферментов синтеза и распада гликогена в печени регулируется также Са++ – выход кальция из внутриклеточных депо в цитозоль клетки контролируется инозитолтрифосфатом, который освобождается фосфолипазой С при распаде входящего в состав мембраны фосфатидилинозитол пирофосфата.
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 482; Нарушение авторских прав?; Мы поможем в написании вашей работы!