
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окисление. Таутомерия – явление обратимой изомерии, при которой два или более структурных изомера (таутомера) находятся между собой в подвижном равновесии [4]
|
|
|
|
Химические свойства
Таутомерия
Таутомерия – явление обратимой изомерии, при которой два или более структурных изомера (таутомера) находятся между собой в подвижном равновесии [4].
Мутаротация – изменение со временем угла вращения плоскости поляризации света до постоянной величины растворами моно- или олигосахаридовÜ, в которых соотношение таутомерных форм не является равновесным.
Окисление бромом [25].
Скорость реакции обратно пропорциональна кислотности среды. Для связывания выделяющейся бромистоводородной кислоты применяют карбонаты кальция или бария.
Окислению молекулярным бромом или трибромид-ионом подвергается β-пиранозная форма. Предложен следующий механизм такого окисления:
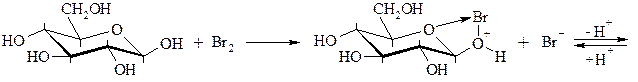

Электрохимическим окислением глюкозы в присутствии бромида кальция и карбоната кальция в фармацевтической промышленности получают кальция глюконат. При электролизе бромида кальция на аноде выделяется свободный бром, который окисляет глюкозу до глюконовой кислоты. Глюконовая и бромоводородная кислота нейтрализуется карбонатом кальция. Образующийся бромид кальция вновь подвергают электролизу [2].
Окисление солями тяжёлых металлов.
а) Реакция Троммера: взаимодействие углевода с гидроксидом меди в щелочной среде при нагревании. Раствор сульфата меди (+2) смешивают с избыточным количеством раствора щёлочи, при этом выделяется аморфный голубой осадок гидроксида меди (2+). Затем добавляют сахар, и окраска становится синей: гидроокись меди реагирует с углеводом, образуя раствор хелата (качественная реакция на α-гликольный фрагмент). При нагревании наблюдается жёлтый осадок гидроксида меди (+1), разлагающийся до нерастворимого красного оксида меди (+1). Из сахара образуется гликуроновая кислота и другие органические вещества, продукты более глубокого окисления.








б) Окисление реактивом Фелинга: взаимодействие углевода с комплексной солью, образующейся при смешивании сульфата меди и калий-натриевой соли винной кислоты, при нагревании. Окислительно-восстановительные процессы, протекающие в ходе этой реакции, аналогичны таковым в реакции Троммера.






в) Окисление реактивом Толленса: взаимодействие с аммиачным раствором оксида серебра (+1) при нагревании. Реактив готовят, смешивая нитрат серебра с гидроксидом натрия и растворяя выпавший Ag2O в водном аммиаке. Металическое серебро часто осаждается на стенке сосуда в виде зеркального покрытия [21]. Кроме гликоновой кислоты, как и во всех предыдущих случаях, образуются побочные органические продукты разложения [23].


Растворы кетоз также дают все упомянутые окислительные реакции, но признаки взаимодействия наступают медленно, поскольку реагируют не сами кетополиолы, а альдозы, образующиеся в результате изомеризации.
5.2. Образование и гидролиз гликозидов [25]
Гидролиз гликозидов катализируется кислотами и лишь в некоторых случаях основаниями; большинство гликозидов устойчиво к действию щелочей.
О-Гликозиды
Простейшие O-гликозиды получают действием избытка спирта на моносахарид в присутствии кислых катализаторов. Эта реакция, открытая Фишером в 1893 году, приводит к равновесной смеси всех четырёх возможных гликозидов, в которой, как правило, преобладают пиранозиды. Превращение может идти как по представленному здесь механизму SN1, так и по механизму SN2.

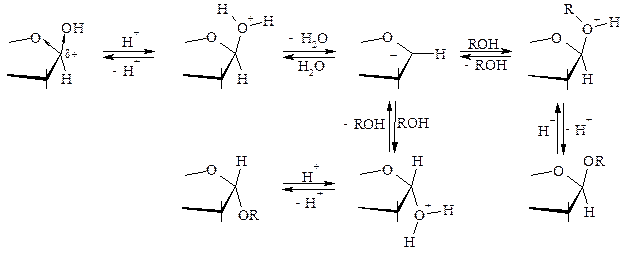
В реакцию вступают преимущественно пятичленные циклы: по-видимому, фуранозы способны образовывать оксониевый ион легче, чем пиранозы; однако после возникновения гликозида происходит изомеризация фуранозидов в пиранозиды со смещением равновесия в сторону образования последних.
Многие О-гликозиды сравнительно легко гидролизуются в кислой среде (реакция, обратная реакции получению гликозидов). Скорость гидролиза зависит от строения моносахаридного остатка и природы агликона. Скорость, как правило, падает в ряду 2-дезоксиальдозы > пентозы > гексозы > гептозы > аминосахара и уроновые кислоты. Фуранозиды гидролизуются приблизительно в 100 раз быстрее изомерных пиранозидов. Гликозиды с ароматическими агликонами обычно гидролизуются значительно быстрее, чем алифатические аналоги.
Гликозиды фенолов, енолов, β-оксикарбонильных и родственных им соединений с электроотрицательными группами в β-положении к гликозидной связи в щелочной среде подвергаются деструкции, приводящей к расщеплению гликозидной связи.
S-Гликозиды (тиогликозиды)
В отличие от О-гликозидов, тиогликозиды, как правило, не удается получить действием тиолов на сахара. Наиболее общий и совершенный метод получения тиогликозидов основывается на конденсации сульфидов с ацилгалогенозами. Эту реакцию проводят в водно-ацетоновых растворах или в спирте, обычно при комнатной температуре. Образующиеся гликозиды, как правило, имеют 1,2- транс -конфигурацию.
Ацилгалогенозы, в свою очередь, получают из полностью ацилированных циклических форм сахаров, используя насыщенные растворы галгеноводородов в уксусной кислоте или в её смеси с уксусным ангидридом.

ацилгалогеноза S-гликозид
Тиогликозиды способны гидролизоваться кислотами с образованием меркаптанов и соответствующих моносахаридов по тому же механизму, что и О-гликозиды (см. схему образования – гидролиза). Однако эти соединения значительно более устойчивы к кислотному гидролизу, чем их кислородные аналоги. Это объясняется пониженной основностью атома серы по сравнению с кислородом, что затрудняет протонирование на первой стадии реакции и уменьшает концентрацию иона тиония.
В присутствии хлорной ртути гидролиз S-гликозидов происходит достаточно быстро и даёт соответствующий моносахарид. Эта реакция специфична для тиогликозидов.
При нагревании с концентрированными растворами щелочей S-гликозиды претерпевают распад с разрывом гликозидной связи. Эта реакция аналогична щелочной деструкции О-арилгликозидов, но протекает в более жёстких условиях.
N-Гликозиды
Важнейшие из известных N-гликозидов представлены тремя типами соединений: а) гликозиламины, то есть продукты N-гликозилирования аммиака и алифатических или ароматических аминов; б) гликозилмочевины, или гликозилуреиды, то есть продукты N-гликозилирования мочевины и её производных; в) нуклеозиды.
Гликозиламины и гликозилуреиды могут быть получены прямой конденсацией аминов, мочевины или её производных с моносахаридами.
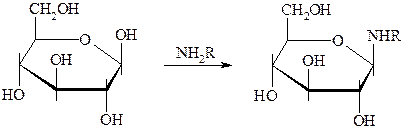
Основным методом искусственного построения гликозидной связи в нуклеозидах является взаимодействие ацилгалогеноз (см. выше) с серебряными, ртутными солями и некоторыми другими производными гетероциклических оснований. В качестве исходных соединений для синтеза нуклеозидов могут быть использованы также гликозилуреиды, при этом осуществляют циклизацию остатка мочевины в этих соединениях действием подходящих реагентов с образованием гетероциклического ядра.
При сборке звеньев нуклеиновых кислот в организме стадия образования нуклеозидов отсутствует. Пиримидиновые нуклеотиды строятся взаимодействием 5-фосфорибозил-1-α-пирофосфата с оротатом (ионом урацилкарбоновой-4 кислоты) и дальнейшей модификацией образовавшегося соединения до урацила, цитозина и тимина. Пуриновые нуклеотиды образуются также из 5-фосфорибозил-1-α-пирофосфата, но азотсодержащий гетероциклический фрагмент монтируется уже на рибозофосфатном остове [9].


5-фосфорибозил-1-α-пирофосфат оротат
Гликозиламины являются наиболее легко гидролизующимися представителями класса гликозидов. Их гидролиз катализируется как кислотами, так и основаниями, и в некоторых случаях протекает даже без катализатора. Эта реакция приводит к выделению соответствующего амина или аммиака и к образованию свободного моносахарида.
Гликозилмочевины значительно более устойчивы к кислотному и щелочному гидролизу, чем гликозиламины.
Нуклеозиды устойчивы к щелочам и достаточно медленно гидролизуются кислотами [25]. Нуклеозиды пуриновых оснований гидролизуются легче пиримидиновых [23].
5.3. Взаимодействие с фенилгидразинами [21, 25, 16]
Действием эквимолекулярного количества арилгидразина (чаще всего фенилгидразина) на моносахарид получают арилгидразон.
При взаимодействии моносахаридов с избытком арилгидразина реакция не останавливается на стадии образования гидразона. Избыток арилгидразина действует как окислитель, что приводит к образованию в молекуле моносахарида новой карбонильной группы. Арилгидразин при этом восстанавливается до соответствующего амина и аммиака, а вновь возникшая карбонильная группа реагирует с новой молекулой арилгидразина с образованием озазона [25].

манноза фенилгидразон
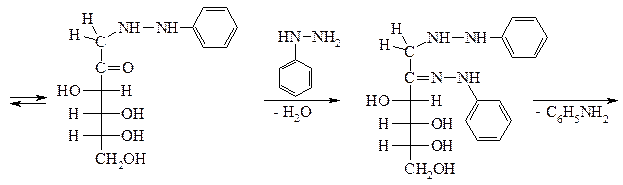

озазон
Гидролиз озазонов приводит к дикарбонильным соединениям, которые получили название озонов. При восстановлении озазонов в определённых условиях (например цинком в уксусной кислоте) сначала восстанавливается альдегидная группа, в результате чего образуются кетозы [25].

озазон кетальдегид (озон) фруктоза
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 2049; Нарушение авторских прав?; Мы поможем в написании вашей работы!