
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 1. Рассчитаем величины, указанные в задании 1, для водного раствора перхлората магния с моляльной концентрацией m = =3,0 моль/кг воды
|
|
|
|
Рассчитаем величины, указанные в задании 1, для водного раствора перхлората магния с моляльной концентрацией m = =3,0 моль/кг воды.
1) Запишем уравнение реакции электролитической диссоциации перхлората магния:
Mg(ClO4)2 = Mg2+ + 2ClO4–
Примем, что при растворении в воде данное вещество диссоциирует на ионы нацело и необратимо, поскольку оно является сильным электролитом. Следовательно, концентрация ионов магния равна, а концентрация перхлорат-ионов вдвое больше аналитической концентрации перхлората магния: m (Mg2+) = m (Mg(ClO4)2) = m, m (ClO4–) = 2∙ m (Mg(ClO4)2) = 2 m.
Таким образом, ионная сила I водного раствора тетраоксохлората(VII) магния согласно формуле (1.3) будет выражаться так:
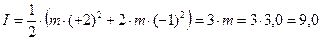 моль/кг воды.
моль/кг воды.
2) Среднюю ионную моляльность m± вычислим по уравнению (1.2):
m ±(Mg(ClO4)2) = 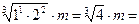 1,587×3,0 = 4,76 моль/кг воды.
1,587×3,0 = 4,76 моль/кг воды.
3) Среднюю ионную активность a ± рассчитаем по формуле (1.4), в которую подставим справочное значение среднего ионного моляльного коэффициента активности g ± для перхлората магния:
g ±(Mg(ClO4)2) = 9,19 [²Краткий справочник…², табл. 72, стр. 131].
a ±(Mg(ClO4)2) = 9,19 ×4,76/1 = 43,76.
4) Общую активность a электролита найдем в соответствии с формулой (1.5):
а (Mg(ClO4)2) = (43,76)3 = 8,380×104.
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 529; Нарушение авторских прав?; Мы поможем в написании вашей работы!