
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамика электрохимических систем
|
|
|
|
Термодинамическая система, в которой происходит взаимное превращение химической и электрической форм энергии, называется электрохимической системой, или электрохимической цепью.
При записи формул электрохимических цепей следует руководствоваться системой обозначений, установленной Международной конвенцией об ЭДС и электродных потенциалах (1953 г., с дополнениями 1973 г.):
· Вертикальная черта ô разделяет две фазы, находящиеся в контакте между собой.
· Запятой отделяются различные ионы или молекулы, сосуществующие в одной и той же фазе (в растворе или расплаве).
· Двойная вертикальная черта ôô обозначает солевой мостик, обеспечивающий контакт между двумя растворами электролитов и устраняющий диффузионный потенциал.
· Символом Pt обозначают индифферентный электрод.
· Запись формулы электрода начинают с фазы раствора. При этом первой указывают окисленную ионную форму. Газовую фазу приводят после жидкой.
· В формуле электрохимической цепи справа размещают электрод с бόльшим значением стандартного электродного потенциала.
· Правильно разомкнутая электрохимическая цепь начинается и заканчивается проводником из одного и того же металла.
Реакции, протекающие на электродах, записывают как процессы восстановления. Сначала приводят уравнение реакции на правом электроде, затем – на левом. Находят наименьшее общее кратное количества электронов, переносимых в элементарных электродных реакциях, и умножают каждое уравнение на соответствующий коэффициент. Вычитая из первого уравнения второе, получают уравнение реакции для электрохимической цепи в целом.
По определению, стандартная ЭДС электрохимической цепи выражается как разность стандартных потенциалов правого и левого электродов:
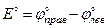
| (3.1) |
Выражение для ЭДС электрохимической цепи при 25 ºС согласно уравнению Нернста имеет вид:
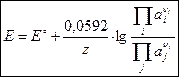 , ,
| (3.2) |
где Е – ЭДС электрохимической цепи при данных активностях ионов;
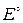 – стандартная ЭДС, В;
– стандартная ЭДС, В;
z – количество электронов, переносимых в элементарном электрохимическом акте;
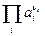 и
и 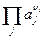 – произведения активностей потенциал-определяющих ионов соответственно исходных веществ и продуктов реакции в степенях, соответствующих стехиометрическим коэффициентам при этих веществах в уравнении химической реакции, протекающей в электрохимической цепи;
– произведения активностей потенциал-определяющих ионов соответственно исходных веществ и продуктов реакции в степенях, соответствующих стехиометрическим коэффициентам при этих веществах в уравнении химической реакции, протекающей в электрохимической цепи;
0,0592 В = 2,303 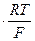 при 25 °С;
при 25 °С;
R = 8,314 Дж/(моль×К) – универсальная газовая постоянная;
F = 96485 Кл/моль – постоянная Фарадея.
Используя уравнение для стандартного химического сродства
| DrG° = – RT ln Kа, | (3.3) |
и уравнение, связывающее DG° со стандартной ЭДС,
| DG° = –zFE°, | (3.4) |
получим выражение стандартной ЭДС электрохимической цепи через термодинамическую константу равновесия Ка:
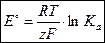
| (3.5) |
Изменение энтропии DrS° в ходе электрохимической реакции связано с температурным коэффициентом ЭДС 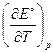 уравнением:
уравнением:
DrS° = zF 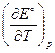
| (3.6) |
Тепловой эффект Qp электрохимической реакции определяется согласно второму началу термодинамики:
| Qp = T×DrS° | (3.7) |
Рассчитав энтропию DrS° и энергию Гиббса DG° химической реакции, можно найти энтальпию DrН° реакции по уравнению Гиббса-Гельмгольца:
| DrH° = DrG° + T×DrS° | (3.8) |
Для обратимо работающей электрохимической цепи максимальная полезная работа W¢max представляет собой максимальную электрическую работу 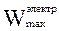 , которая совершается за счет убыли энергии Гиббса:
, которая совершается за счет убыли энергии Гиббса:
W¢max = 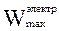 = –(DrG)p,T = z×F×Е = –(DrG)p,T = z×F×Е
| (3.9) |
Условия заданий
Задание 3
Вычислите произведение растворимости (ПР) и растворимость (S) малорастворимого сильного электролита, представленного в табл. 3, по значениям стандартных электродных потенциалов в водных растворах при 25 °С. Рассчитайте ПР этого электролита по величинам стандартной энергии Гиббса образования ионов в водных растворах при 25 °С.
Задание 4
1) Составьте электрохимическую цепь из компонентов, указанных в табл. 4.
2) Запишите уравнения реакций, протекающих на электродах и в электрохимической цепи в целом.
3) Рассчитайте ЭДС электрохимической цепи.
4) Определите DG° и DG реакции, протекающей в электрохимической цепи.
5) Найдите термодинамическую константу равновесия Ka реакции, протекающей в электрохимической цепи, и рассчитайте соотношение активностей ионов для изменения направления тока в цепи на обратное.
Задание 5
1) Для указанной в табл. 5 обратимой реакции составьте электрохимическую цепь.
2) Найдите термодинамические характеристики указанной реакции (DrS°, DrG° и DrH°), а также максимальную полезную работу W¢max при 25 ºС.
3) Определите количество теплоты Qp, выделяемой или поглощаемой электрохимической цепью. Как эта электрохимическая система будет работать в адиабатических условиях (с разогревом или охлаждением) и в изотермических условиях (с выделением или поглощением теплоты)?
4) Вычислите изменение внутренней энергии DrU° в ходе реакции.
При проведении расчетов рекомендуется использовать ²Краткий справочник физико-химических величин²/Под ред. А.А. Равделя и А.М. Пономаревой. Л., 1983; СПб., 1999 или СПб., 2002, именуемый далее ²Кратким справочником…².
Таблицы исходных данных
Таблица 3. Исходные данные к заданию 3.
| № вар. | Электролит | 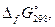 кДж/моль
кДж/моль
| № вар. | Электролит | 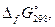 кДж/моль
кДж/моль
|
| AgBr | Hg2Cl2 | ||||
| AgI | Hg2Br2 | ||||
| AgIO3 | -92 | Hg2I2 | -111 | ||
| AgCN | Hg2SO4 | ||||
| Ag2SO4 | Ni(OH)2 | -459 | |||
| Ag2CrO4 | -635 | PbBr2 | 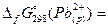 =-24 кДж/моль =-24 кДж/моль
| ||
| Ag2S | PbI2 | ||||
| Ca(OH)2 | PbSO4 | ||||
| CdCO3 | -674 | PbS | |||
| Cd(OH)2 | -474 | TlCl | |||
| Co(OH)2 | -456 | TlI | -125 | ||
| CuCl | Zn(OH)2 | ||||
| CuI | -70 | ZnS | |||
| Fe(OH)2 | -493 | Ca(OH)2 |
Примечание. В табл. 3 приведены стандартные энергии Гиббса образования веществ, отсутствующие в ²Кратком справочнике…².
Таблица 4. Исходные данные к заданию 4.
| № ваp. | A | B | M1 | C | D | M2 | а (A) | a (B) | a (C) | a (D) |
| Cu2+ | — | Cu | Br2(ж) | Br– | Pt | 0,02 | — | 0,03 | ||
| Cu2+ | — | Cu | O2 | OH– | Pt | 0,03 | — | 1,5 | 0,02 | |
| Cr3+ | — | Cr | Cl2 | Cl– | Pt | 0,05 | — | 1,2 | 0,02 | |
| Fe3+ | Fe2+ | Pt | Cr3+ | Cr2+ | Pt | 0,005 | 0,15 | 0,1 | 0,001 | |
| Fe(CN)63– | Fe(CN)64– | Pt | Co3+ | Co2+ | Pt | 0,06 | 0,06 | 0,04 | 0,005 | |
| Ag+ | — | Ag | Ag2O | OH– | Ag | 0,04 | — | 0,03 | ||
| Co3+ | Co2+ | Pt | Fe(CN)63– | Fe(CN)64– | Pt | 0,04 | 0,009 | 0,06 | 0,001 | |
| H+ | H2 | Pt | O2 | OH– | Pt | 0,04 | 1,5 | 0,5 | 0,06 | |
| H+ | H2 | Pt | Cl2 | Cl– | Pt | 0,05 | 0,6 | 0,5 | 0,02 | |
| Cl2 | Cl– | Pt | AgCl | Cl– | Ag | 1,5 | 0,04 | 0,04 | ||
| AgI | I– | Ag | AgCl | Cl– | Ag | 0,02 | 0,06 | |||
| Cu2+ | Cu+ | Pt | Sn4+ | Sn2+ | Pt | 0,14 | 0,009 | 0,002 | 0,08 | |
| H3AsO4 | HAsO2 | Pt | MnO4– | MnO42– | Pt | 0,08 | 0,04 | 0,02 | 0,007 | |
| V3+ | V2+ | Pt | Tl3+ | Tl+ | Pt | 0,016 | 0,007 | 0,001 | 0,1 | |
| Hg22+ | Hg | Pt | Cl2 | Cl– | Pt | 0,04 | 0,8 | 0,06 | ||
| H3AsO4 | HAsO2 | Pt | V3+ | V2+ | Pt | 0,15 | 0,005 | 0,005 | 0,01 | |
| O2 | OH– | Pt | AgI | I– | Ag | 1,5 | 0,05 | 0,04 | ||
| H2 | OH– | Pt | O2 | OH– | Pt | 2,0 | 0,02 | 0,8 | 0,02 | |
| Ag+ | — | Ag | S2O62– | SO42– | Pt | 0,02 | — | 0,07 | 0,03 | |
| Ag2SO4 | SO42– | Ag | V3+ | V2+ | Pt | 0,02 | 0,01 | 0,02 | ||
| PbBr2 | Br– | Pb | S2O62– | SO42– | Pt | 0,005 | 0,005 | 0,03 | ||
| MnO4– | MnO42– | Pt | Mn2+ | MnO4– | Pt | 0,009 | 0,014 | 0,07 | 0,009 | |
| Mn2+ | MnO4– | Pt | Sn4+ | Sn2+ | Pt | 0,01 | 0,02 | 0,08 | 0,15 | |
| Fe3+ | Fe2+ | Pt | I3– | I– | Pt | 0,02 | 0,03 | 0,01 | 0,04 | |
| Ni2+ | — | Ni | I3– | I– | Pt | 0,01 | — | 0,03 | 0,06 | |
| Hg22+ | Hg | Pt | AgBr | Br– | Ag | 0,08 | 0,01 | |||
| MnO4– | MnO42– | Pt | Fe3+ | Fe2+ | Pt | 0,018 | 0,005 | 0,15 | 0,05 | |
| PbSO4 | SO42– | Pb | Br2(ж) | Br– | Pt | 0,05 | 0,05 |
Примечание. В таблице 4 введены следующие обозначения: М1 и М2 – металлические электроды; A, B, C, D – ионы или молекулы, присутствующие в приэлектродном электролите; a (A), a (B), a (C), a (D) – соответствующие активности. Активность воды принимается равной единице. В вариантах, номера которых обведены рамкой №, активность протонов a (H+) принять равной 0,2.
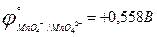
Таблица 5. Исходные данные к заданию 5.
| № вар. | Уравнение реакции | 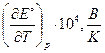
|
Zn + 2AgCl  ZnCl2 + 2Ag ZnCl2 + 2Ag
| -7,57 | |
Zn + Hg2SO4  ZnSO4 + 2Hg ZnSO4 + 2Hg
| -9,48 | |
Cd + Hg2SO4  CdSO4 + 2Hg CdSO4 + 2Hg
| -7,95 | |
Cd + 2AgCl  CdCl2 + 2Ag CdCl2 + 2Ag
| -6,04 | |
Cd + PbCl2  CdCl2 + Pb CdCl2 + Pb
| -4,16 | |
Zn + Hg2Cl2  ZnCl2 + 2Hg ZnCl2 + 2Hg
| -4,13 | |
Pb + 2AgI  PbI2 + 2Ag PbI2 + 2Ag
| -1,83 | |
2Hg + 2AgCl  Hg2Cl2 + 2Ag Hg2Cl2 + 2Ag
| -3,44 | |
Pb + Hg2Cl2  PbCl2 + 2Hg PbCl2 + 2Hg
| 1,57 | |
Mg + 2HCl  MgCl2 + H2 MgCl2 + H2
| -1,13 | |
2Cu + I2  2CuI 2CuI
| 0,60 | |
2FeCl3 + H2  2FeCl2 + 2HCl 2FeCl2 + 2HCl
| 11,88 | |
Fe + NiCl2  FeCl2 + Ni FeCl2 + Ni
| 0,80 | |
2Al + Cr2(SO4)3  Al2(SO4)3 + 2Cr Al2(SO4)3 + 2Cr
| -3,13 | |
Pb + Ag2S  PbS + 2Ag PbS + 2Ag
| -1,66 | |
Pb + I2  PbI2 PbI2
| -0,29 | |
2Cr + 3SnCl2  2CrCl3 + 3Sn 2CrCl3 + 3Sn
| -4,28 | |
Cu + 2AgNO3  Cu(NO3)2 + 2Ag Cu(NO3)2 + 2Ag
| -9,72 | |
3Zn + 2CrCl3  3ZnCl2 + 2Cr 3ZnCl2 + 2Cr
| 0,37 | |
Pb + Cu(CH3COO)2  Cu + Pb(CH3COO)2 Cu + Pb(CH3COO)2
| 1,90 | |
Fe + CuSO4  FeSO4 + Cu FeSO4 + Cu
| -0,76 | |
AgNO3 + Fe(NO3)2  Fe(NO3)3 + Ag Fe(NO3)3 + Ag
| -21,84 | |
2Cr + 3Cl2  2CrCl3 2CrCl3
| -13,94 | |
2Hg + Ag2SO4  Hg2SO4 + 2Ag Hg2SO4 + 2Ag
| -3,42 | |
2Hg + 2AgCl + H2SO4  Hg2SO4 + 2Ag + 2HCl Hg2SO4 + 2Ag + 2HCl
| 1,91 | |
Cd + Hg2Cl2  CdCl2 + 2Hg CdCl2 + 2Hg
| -2,60 | |
2Ag + Cl2  2AgCl 2AgCl
| -5,99 | |
Zn + CuSO4  ZnSO4 + Cu ZnSO4 + Cu
| -1,37 |
Рассмотрим выполнение каждого задания на примерах.
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 923; Нарушение авторских прав?; Мы поможем в написании вашей работы!