
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение БЭТ
|
|
|
|
Уравнение Лангмюра
Для дано теории харны след допущения: адсорбция ограничивается образованием на повти адсорбента мономолекулярного слоя молекул адсорбата,адсорированные молекулы не взаимодействуют друг с другом,повть адсорбента энергетически однородна.
В рамках данных допущений изотерма адсорбции паров газов на повти тв адсорбентов описывается урнием Лэнг-Мюра. A=Ambc/(1+bc)
С/А=(1/Аmb)+(C/Am),где А-величина адсорбции(моль/г), Am-предельная адсорбция соотв покрытию повти адсорбента мономолекулярным слоем адсорбата(моль/г), b- константа адсорбционного взаимодействия характер энергию взаимодействие молекул адсорбата и адсорбента, С-равновесная концентрация адсорбата. Урние Лангмюра в линейной форме обычно используют для определения константы b и величины предельной адсорбции. Зная величину предельной адсорбции можно определить удельную повтьадсорбента Sуд=AmNAω, ω-площадь занимаемая одной молекулой адсорбата.
теория Лэнгмюра применима для описания хемосорбции ионного обмена физической адсорбции газов при невысоких давлениях.Основное несоответствие теории Лэнгмюра на практике в том что мономолекулярный слой не компенсирует полностью избыточную пов энергию. Теория БЭТ основана на следующих допущениях:повть адсорбента энергитически однородна, адсорбированные молекулы не взаимодействуют друг с другом по горизонтали,на повти адсорбента формируются последовательно комплексы из одной двух трех и т.д. адсорбированных молекул причем взаимод между молекулами по вертикали во втором и последующих слоях такое же как и при взаимодействии между ними в жилком состоянии.
В теории БЭТ предполагается что адсорбционный слой можно рассматривать как пленку жидкости определенного объема и тогда адсорбция это переход компонента из газовой фазы в псевдожидкую на повти адсорбента. А- адсорбент,В молекулы абсорбата.то процесс адсорбции по БЭТ мона представить как ряд хим реакций A0+В↔АВ1; АВ1+В↔АВ2;АВ2+В↔АВ3. Тогда для данных реакций можно записать Кр=АВ1/А0*В,К1=АВ2/АВ1*В,К2=АВ3/АВ2*В
Отсюда можно найти колво адсорбционных центров в любой момент времени.
В данной теории принято что энергия взаимодействия молекул адсорбат/адсорбент во втором и последующих слоях такая же адсорбат/адсорбент в жидком состоянии, тогда данные константы равны между собой Кр=К1=К2=am/ap=1/ps=KL.
KL -константа конденсации жидкости. Она равна отношению активности вва в жидком состоянии к его активности в виде пара. В стандартных условиях am=1,а ap=давлению насыщенного пара жидкости при постоянной Т.Величина общей адсорбции равна сумме адсорбций всех моно слоев:A=(am*C*(p/ps))/((1-(p/ps)*(1+(c-1)*(p/ps))-урние БЭТ.с-константа кот характерихует разность энергий адсорбции и конденсации. Р-давление пара,ps-давление насыщенного пара.Уравнение БЭТ описывает S образную кривую.Данное уравнение называется обобщенным уравнением Лэнгмюра т.к. при уменьшении давления до 0,3..0,4 уравнение БЭТ переходит в уравнение лэнгмюра.При дальнейшем уменьшении давления урние БЭТ переходит в уравнение Генри т.е. оно обобщает теорию Генри и теорию Лэнгмюра.Оно также как и уравнение лангмюра применяется для определения удельной поверхности.
Адсорбция на неоднородной поверхности.
Поверхность реальных адсорбентов харся энергетической неоднородностью т.е. наличием участков или адсорбционных центров кот имеют разную энергию взаимодействия с молекулами адсорбата. В этом случае общая адорбция может быть определена суммированием величин адсорбции на каждом из участков. Аобщ=ΣАi. Адсорбция на участках может быть рассчитана с помощью любого адсорбционного уравнения.
10. Адсорбция на границе раздела твердое вещество – жидкость.
Явление адсорбции поверхностью твердого тела вещества из раствора сложнее адсорбции газов, паров и чистых жидкостей, так как в этом случае наряду с адсорбатом будет наблюдаться и конкурентная адсорбция растворителя. Кроме того имеет место взаимодействие молекул адсорбата с молекулами среды.
Обычно различают адсорбцию электролитов и неэлектролитов.
Количество вещества, адсорбированного 1 г адсорбента из раствора, определяют по формуле
а = 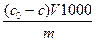 , (4.1) где Со и С – начальная и равновесная концентрации, моль/л, V – объем раствора, л,
, (4.1) где Со и С – начальная и равновесная концентрации, моль/л, V – объем раствора, л,
m – масса адсорбента, г, 1000 - переводной множитель в ммоль/г.
Концентрационная зависимость адсорбции из растворов характеризуется обычной изотермой адсорбции. Для достаточно разбавленных растворов можно пользоваться уравнением Фрейндлиха или уравнением Ленгмюра.
Величина гиббсовской адсорбции определяется экспериментально. Если общее число молей в растворе равно n, мольная доля адсорбата до адсорбции N0, при равновесии N, то
Г = n(N0–N)/msуд, (4.2)
где m – масса адсорбента, sуд – удельная поверхность адсорбента.
Так как природа среды влияет на адсорбцию, то для оценки поведения растворителя можно пользоваться рядом критериев
Чем больше поверхностное натяжение среды, тем хуже ее молекулы адсорбируются на твердом теле.
Другой критерий пригодности растворителя как среды для адсорбции – теплота смачивания адсорбента растворителем. Она определяется по формуле
Q = sуд(E1 – E2), (6.3)
где Е1 и Е2 – полная поверхностная энергия на границе адсорбент–воздух и адсорбент–жидкость. Обычно теплота составляет 1–20 кал/г адсорбента. Чем выше теплота адсорбции, тем лучше растворитель взаимодействует с адсорбентом, тем худшей средой он будет для адсорбции. Можно принять, что чем лучше среда растворяет адсорбат, тем хуже в этой среде идет адсорбция.
Адсорбенты бывают полярные и неполярные. Считается, что неполярные адсорбенты лучше адсорбируют неполярные вещества и наоборот.
При увеличении пористости адсорбента возрастает адсорбция малых молекул адсорбата из раствора. Крупные молекулы не попадают в узкие поры, и адсорбция уменьшается. Это может привести к обращению правила Дюкло–Траубе.
При оценке свойств адсорбента пользуются правилом Ребиндера: вещество С может адсорбироваться на поверхности раздела фаз А и B, если его наличие в поверхностном слое приводит к уравниванию разности полярностей этих фаз. Для примера можно взять диэлектрическую проницаемость. Для выполнения правила необходимо соблюдение соотношения e A > eC > eB, или eA < e C < eB.
Из правила следует, что чем больше разность полярностей между растворимым веществом и раствором, т. е. меньше растворимость вещества, тем лучше оно будет адсорбироваться.
Согласно правилу, дифильные молекулы ПАВ адсорбируются на границе так, что полярная часть обращена к полярной фазе и наоборот.
Исходя из этого можно утверждать, что все полярные гидрофильные поверхности должны хорошо адсорбировать ПАВ из неполярных или слабо полярных жидкостей, а неполярные гидрофобные поверхности хорошо адсорбировать ПАВ из полярных жидкостей.
С увеличением молекулярного веса адсорбата его способность адсорбироваться возрастает. Ароматические соединения адсорбируются лучше алифатических.
Из-за транспортных ограничений адсорбция в растворах идет медленно. Время установления адсорбционного равновесия возрастает с увеличением молекулярного веса кислоты.
С ростом температуры адсорбция из раствора снижается, но в меньшей степени, чем адсорбция газов.
На рис. 4.1 представлена зависимость гиббсовской адсорбции от концентрации.
При высоких концентрациях адсорбата его содержание в поверхностном слое и в объеме раствора становится большим и одинаковым. Этим объясняется снижение адсорбции при больших N.
В точке пересечения с осью абсцисс кривой 3 концентрация поверхностного и объемного растворов одинаковы, и данный адсорбент не может разделить смеси. Такое явление называется азеотропией.
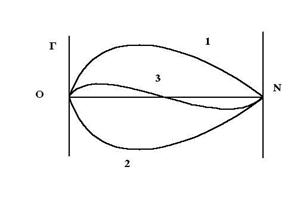
Рис. 4.1. Зависимость Г от мольной доли адсорбата N:
1 – сильная адсорбция адсорбата и слабая растворителя; 2 – cлабая адсорбция адсорбата и сильная растворителя; 3 – cлабая адсорбция компонентов
Адсорбция из растворов играет огромную роль в физико-химических процессах, происходящих в живых организмах. Проникновение веществ через полупроницаемые мембраны начинается с адсорбции.
Адсорбция широко используется в технологических схемах для удаления или концентрирования тех или иных веществ. На явлении адсорбции основаны методы различных видов хроматографического анализа.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1500; Нарушение авторских прав?; Мы поможем в написании вашей работы!