
- Р Р‡.МессенРТвЂВВВВВВВВжер
- ВКонтакте
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ
- РњРѕР№ Р В Р’В Р РЋРЎв„ўР В Р’В Р РЋРІР‚ВВВВВВВВРЎР‚
- LiveJournal
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общая характеристика подгруппы кислорода
|
|
|
|
Общая характеристика элементов 6 группы, возможные степени окисления. изменение окислительно-востановительных свойств соединений в группе в зависимости от степени окисления.
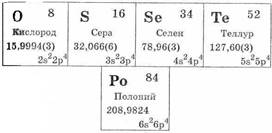
Кислород, сера, селен, теллур и полоний составляют главную подгруппу VI группы и называются халькогенами — «образующими руды».
На внешнем энергетическом уровне атомов элементов данной подгруппы содержится по 6 электронов, которые имеют конфигурацию ns2np4 и распределены по ячейкам следующим образом:
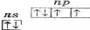
Этим объясняется сходство их химических свойств. Наличие двух неспаренных электронов на наружном уровне указывает на валентность 2 в невозбужденном состоянии Сравнение строения свободных уровней показывает, что у S, Se, Те и Ро в отличие от кислорода имеются вакантные ячейки d-подуровня. Отсутствие свободных орбиталей на внешнем уровне кислорода не дает возможности увеличить число неспаренных электронов, и поэтому единственная валентность его равна 2. Атомы остальных элементов подгруппы имеют на наружном уровне вакантные ячейки d-подуровня, куда при возбуждении (что имеет место при подводе энергии, например при нагревании) могут переходить s- и р-электроны этого же уровня.
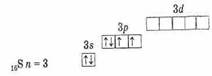
Этим можно объяснить, что у серы и остальных элементов число неспаренных электронов может быть увеличено до 4 и 6 (см. табл. 18).
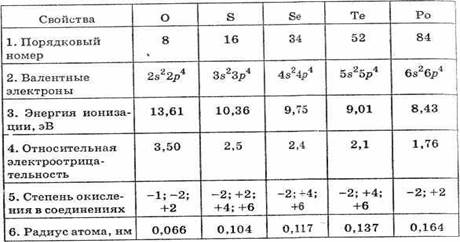
Все халькогены в соединениях с металлами и водородом проявляют степень окисления -2, а в соединениях с кислородом и другими активными неметаллами обычно +4 и +6, что соответствует двум типам оксидов — RO2 и RO3, относящимся к типичным кислотным, которым соответствуют кислоты H2RO3 и H2RO4.
При переходе от кислорода к теллуру увеличиваются радиусы атомов, поэтому усиливаются восстановительные и ослабевают окислительные свойства. По значению электроотрицательности кислород уступает только фтору (степень окисления кислорода в соединениях со фтором +2), поэтому в реакциях со всеми остальными элементами проявляет исключительно окислительные
свойства. Сера, селен и теллур по своим свойствам относятся к группе окислителей-восстановителей. В реакциях с сильными восстановителями проявляют окислительные свойства, а при действии сильных окислителей они окисляются.
Водородные соединения элементов подгруппы кислорода отмечают формуле H2R: Н2O, H2S, H2Se, H2Te. Они называются хальководородами. Их водные растворы обладают слабыми кислотными свойствами. Диссоциация происходит преимущественно по первой ступени:
H++HR-«H2R
Сила этих кислот возрастает с ростом порядкового номера элемента, что объясняется уменьшением энергии связи в ряду соединений H2R. Вода, диссоциирующая на ионы H+ и OH-, является амфотерным электролитом.
Характерно, что халькогены в водородных соединениях находятся в состоянии низшей степени окисления, поэтому проявляют только восстановительные свойства, которые от H2S к Н2Те усиливаются.
С ростом порядкового номера элемента сила кислот типа H2RO3 и H2RO4 убывает. Все они проявляют окислительные свойства, а кислоты типа H2RO3 еще и восстановительные.
|
|
|
Дата добавления: 2015-08-31; Просмотров: 4769; Нарушение авторских прав?; Мы поможем в написании вашей работы!