
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Серный ангидрид. Серная кислота. Соли серной кислоты. Получение , свойства, применение
|
|
|
|
Окси́д се́ры (VI) (се́рный ангидри́д, трео́кись се́ры, се́рный га́з) SO3 — высший оксид серы, тип химической связи: ковалентная полярная химическая связь. В обычных условиях легколетучая бесцветная жидкость с удушающим запахом. При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3.
Находящиеся в газовой фазе молекулы SO3 имеют плоское тригональное строение с симметрией D3h (угол OSO = 120°, d(S-O) = 141 пм.) При переходе в жидкое и кристаллическое состояния образуются циклический тример и зигзагообразные цепи.
Твёрдый SO3 существует в α-, β-, γ- и δ-формах, с температурами плавления соответственно 16,8, 32,5, 62,3 и 95 °C и различающихся по форме кристаллов и степени полимеризации SO3. α-форма SO3 состоит преимущественно из молекул триме́ра. Другие кристаллические формы серного ангидрида состоят из зигзагообразных цепей: изолированных у β-SO3, соединенных в плоские сетки у γ-SO3 или в пространственные структуры у δ-SO3. При охлаждении из пара сначала образуется бесцветная, похожая на лёд, неустойчивая α-форма, которая постепенно переходит в присутствии влаги в устойчивую β-форму — белые «шёлковистые» кристаллы, похожие на асбест. Обратный переход β-формы в α-форму возможен только через газообразное состояние SO3. Обе модификации на воздухе «дымят» (образуются капельки H2SO4) вследствие высокой гигроскопичности SO3.
Взаимный переход в другие модификации протекает очень медленно. Разнообразие форм триоксида серы связано со способностью молекул SO3 полимеризоваться благодаря образованию донорно-акцепторных связей. Полимерные структуры SO3 легко переходят друг в друга, и твердый SO3 обычно состоит из смеси различных форм, относительное содержание которых зависит от условий получения серного ангидрида.
Получение
Получают, окисляя оксид серы (IV) кислородом воздуха при нагревании, в присутствии катализатора (V2O5, Pt, NaVO3 или оксид железа(III) Fe2O3):
Можно получить термическим разложением сульфатов:

или взаимодействием SO2 с озоном:

Для окисления SO2 используют также NO2:

Эта реакция лежит в основе исторически первого, нитрозного способа получения серной кислоты.
Химические свойства
1. Кислотно-основные: SO3 — типичный кислотный оксид, ангидрид серной кислоты. Его химическая активность достаточно велика. При взаимодействии с водой образует серную кислоту:

Однако в данной реакции серная кислота образуется в виде аэрозоля, и поэтому в промышленности оксид серы(VI) растворяют в серной кислоте с образованиемолеума, который далее растворяют в воде до образования серной кислоты нужной концентрации.
Взаимодействует с основаниями:
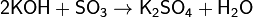
и оксидами:

SO3 растворяется в 100%-й серной кислоте, образуя олеум.
' 2'. Окислительно-восстановительные: SO3 характеризуется сильными окислительными свойствами, восстанавливается, обычно, до сернистого ангидрида:


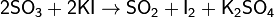
3. При взаимодействии с хлороводородом образуется хлорсульфоновая кислота:

Также взаимодействует с двухлористой серой и хлором, образуя тионилхлорид:
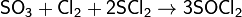
Применение
Серный ангидрид используют в основном в производстве серной кислоты.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 2735; Нарушение авторских прав?; Мы поможем в написании вашей работы!