
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Получение. Оксид серы (VI). Серная кислота
|
|
|
|
Оксид серы (VI). Серная кислота
Оксид серы (VI) (см. табл. 20) — бесцветная жидкость, затвердевающая при температуре 16,8°С в твердую кристаллическую массу. Он очень сильно поглощает влагу, образуя серную кислоту: SO3+Н2O= H2SO4
Таблица 20. Свойства оксидов серы

Растворение оксиды серы (VI) в воде сопровождается выделением значительного количества теплоты. Оксид серы (VI) очень хорошо растворим в концентрированной серной кислоте. Раствор SO3 в безводной кислоте называется олеумом. Олеумы могут содержать до 70% SO3.
1. Оксид серы (VI) получают окислением сернистого газа кислородом воздуха в присутствии катализаторов при температуре 450°С (см. Получение серной кислоты):
2SO2+O2=2SO3
2. Другим способом окисления SO2 до SO3 является использование в качестве окислителя оксида азота (IV):
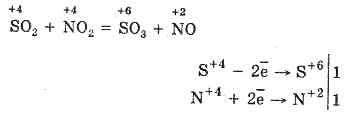
Образующийся оксид азота (II) при взаимодействии с кислородом воздуха легко и быстро превращается в оксид азота (IV): 2NO+О2=2NO2
который вновь может использоваться в окислении SO2. Следовательно, NO2 выполняет роль переносчика кислорода. Этот способ окисления SO2 до SO3 называется нитрозным. Молекула SO3 имеет форму треугольника, в центре которого
находится атом серы:

Такое строение обусловлено взаимным отталкиванием связывающих электронных пар. На их образование атом серы предоставил шесть внешних электронов.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 844; Нарушение авторских прав?; Мы поможем в написании вашей работы!