
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методичні вказівки 2 страница
|
|
|
|
Гомологи бензолу окислюються значно легше бензолу. Але в них ароматичне ядро більш стійке до дії окислювачів, ніж з'єднані з ядром вуглеводневі радикали. Яким би складним не був боковий ланцюг, він при дії сильних окислювачів руйнується, за винятком атому вуглецю, найближчого до ядра. Атом вуглецю поєднаний з ароматичним ядром, окислюється в карбоксильну групу. За основністю, отриманих кислот роблять висновок про структуру гомологів бензолу.
Дослід 5. Бромування ароматичних вуглеводнів.
Реактиви та матеріали: бензол/ толуол; бром (розчин у чотирьоххлористому вуглеці).
(Дослід проводять у витяжній шафі).
Для проведення досліду беруть 2 сухі пробірки.До одної пробірки містять 2 краплі, до іншої 2 краплі толуолу. У обидві пробірки доливають по краплі розчину брому та трусять упродовж 1-2 хв. Ознакою реакції є виділення бромистого водню, чадного на повітрі, та знебарвлення брому. В пробірці з бензолом реакція бромування не спостерігається. Толуол за цих умов бромується повільно але досить чітко.
Вміст обох пробірок нагрівають до кипіння. Толуол при цьому бромується дуже легко, а бензол не бромується навіть при кип'ятінні.
Хімізм процесу:


Дія хлору та брому на ароматичні сполуки за умов радикальної реакції (нагрівання та освітлення) приводить до заміщення водню у боковому ланцюгу.
Дослід 6. Одержання бензолсульфокислоти.
Реактиви та матеріали: бензол, сірчана кислота (d=l,84 г/см).
До пробірки містять 3 краплі бензолу та 5 крапель концентрованої сірчаної кислоти. Вміст пробірки нагрівають у киплячий водяній бані при постійному збовтуванні реакційної суміші.
Після отримання однорідного розчину зливають сульфомасу до пробірки з 10 краплями холодної води. Якщо сульфування завершилось повністю ю, то утворюється прозорий розчин, так як сульфокислоти розчинні у воді.
Хімізм процесу:

Легкість сульфування при дії сірчаної кислоти також характерна для ароматичних сполук, як і здатність до нітрування. Реакція сульфування, на відміну від реакції галогенування та нітрування - зворотна.
Для того щоб повністю використати сірчану кислоту, реакцію сульфування проводять у надлишку бензолу при нагріванні.
Дослід 7. Одержання трифенілметану.
Реактиви та матеріали: бензол, хлороформ, хлористий алюміній, зневоднений порошок.
(Дослід проводять у витяжній шафі).
До сухої пробірки містять трохи хлориду алюмінію, 4 краплі бензолу та 2 краплі хлороформу. Вміст пробірки трохи нагрівають. Реакція йде дуже енергійно, виділяється гадячій на повітрі хлороводень. Внаслідок реакції утворюється густе забарвлене масло.
Хімізм процесу:
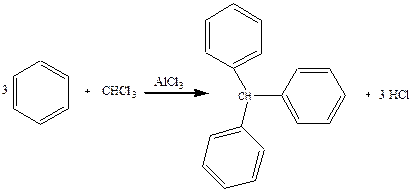
Хлорид алюмінію утворює-з початковими, а іноді з кінцевими продуктами реакції маслоподібні комплексні сполуки. Для виділення чистого остаточного продукту комплекс руйнують соляною кислотою. Три фенольних ядра діють на атом водню при третинному вуглеці, тому цей атом водню мас особливо високу реакційну здатність, легко окислюється. легко заміщується на атом хлору або брому.
Заняття №6
Гідроксильні сполуки та їх похідні.
Контрольні запитання:
1.Які спирти утворюються внаслідок лужного гідролізу:
а) бромистого втор-бугилу б) 1-йод-4 - метилпентану в) 3-бромбутену 2.
І') 2.3-дібромбугану. Назвіть ці спирти?
2. Напишіть рівняння реакції внутрішньо молекулярної дегідратації:
а) 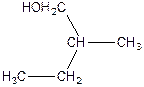
б) 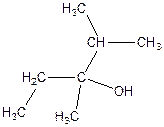
в) 
г) 
3. Речовина С5Н12O при нагріванні з оцтовою кислотою у присутності Н2SO4 дає сполуку C7H14O2. На першій стадії окислення вона утворює сполуку С5H10O, а при подальшому окисленні - суміш оцтової та пропіонової кислот. Визначити будову речовини С5Н12O Напишіть рівняння всіх перелічених реакцій.
4. Напишіть реакції, за допомогою яких можна розділити первинний, вторинний й третинний спирт.
5. Отримайте будь яким засобом 2,2,4 - триметилпентанон-3.
Напишіть рівняння реакцій:
а) з метилмагній-йодідом,
б) з бромистоводневою кислотою,
в) з оцтовою кислотою у присутностіH2SO4.
6. Напишіть реакціі фенола, які доводять його кислотні властивості.
Дослід 1. Реактиви та матеріали: реактив Лукаса, пропіловий спирт, ізопропіловий спирт, третинний бутиловий спирт.
Беруть 3 пробірки, нумерують восковим олівцем та приливають до кожного по 2 краплі спирту (до першої -пропиловий, до другої ізопропіловий і до третьої - третинний бутиловий спирт). Після цього до пробірок приливають по 5 крапель реактиву Лукаса (хлористий цинк, розчинений у концентрованій соляній кислоті) збовтують вміст пробірок і залишають їх стояти 2 хвилини. У пробірці з пропіловим спиртом розчин залишається прозорим, розчин ізопропілового спирту трохи мутнішає. а у пробірці з третинним бутиловим спиртом утворюється на дні масляна крапля.
За допомогою проби Лукаса можна встановити чи є цей спирт первинним, вторинним або третинним: первинний спирт залишається прозорим, вторинний -мутнішає, а третинний вступає у хімічну реакцію з утворенням галогеналкілу.
Дослід 2. Відношення спиртів до індикаторів.
Реактиви та матеріали: етиловий спирт, пропіловий спирт, бутиловий спирт, ізоамиловий спирт, фенолфталеїн, 1 % - й спиртовий розчин, лакмусовий папір.
До 4 пробірок містять по 3 краплі води та додають по 3 краплі етилового, пропілового, бутилового та ізоамилового спиртів. Випробовують розчини спиртів на фенолфталеїн та лакмус. Колір індикаторів не змінюється. Спирти показують нейтральну реакцію на індикатори.
Дослід 3. Окислення етилового спирту оксидом міді (II).
Реактиви та матеріали: етиловий спирт, фуксинсірчана кислота, спіраль з мідного дроту.
До сухої пробірки містять 2 краплі етилового спирт). Тримаючи спіраль з мідного дроту пінцетом нагрівають її у полум'ї пальника до виникнення чорного нальоту оксиду міді. Ще гарячу спіраль опускають до пробірки з етиловим спиртом. Чорна поверхня негайно стає золотистою внаслідок відновлення оксиду міді. При цьому відчувається характерний запах оцтового альдегіду (запах яблук).
Підтвердженням утворення оцтового альдегіду може служити кольорова реакція з фуксинсірчаною кислотою.
До пробірки містять 3 краплі розчину фуксинсірчаної кислоти та піпеткою вносять одну краплю отриманого розчину. З являється рожево-фіолетове забарвлення (кольорова реакція на альдегід)
Хімізм процесу:
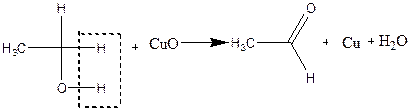
Дослід4. Окислення етилового спирту хромовою сумішшю.
Реактиви та матеріали: етиловий спирт, дихромат калію, 0.5 н розчин сірчана кислота,2 н розчин.
Окислення спиртів за лабораторних умов частіше за все здійснюється хромовою сумішшю. До пробірки містять 2 краплі розчину двохромовокислого калію. Жовтогарячий розчин нагрівають над полум'ям пальника до початку зміни забарвлення на синювато-зелене.
Водночас відчувається характерний запах оцтового альдегід.
Хімізм реакції:


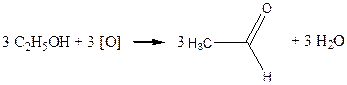
Cr2O3 + 3H2SO4 ® Cr2(SO4)3 + 3H2O

Дослід 5. Взаємодія гліцерину з гідроксидом міді (11).
Реактиви та матеріали: гліцерин, сульфат міді, 0,2 н розчин, їдкий натр, 2 н розчин.
Містять до пробірки 2 краплі розчину сульфату міді, 2 краплі розчину їдкого натру та перемішують - утворюється блакитний студневий осад гідроксиду міді (II). До пробірки додають 1 краплю гліцерину та збовтують вміст. Осад розчиняється та з'являється темно-синє забарвлення внаслідок утворення гліцерату міді.
Хімізм процесу:
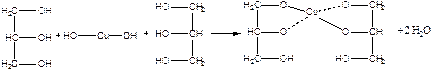
Гліцерин - 3-х атомний спирт. Кислотність його більш, ніж у одноатомних спиртів: збільшення числа гідроксогруп посилює кислотний характер.
Гліцерин легко утворює гліцерати з гідроксидами важких металів. Однак здатність його утворювати металеві похідні (гліцерати) з багатовалентними металами пояснюється не стільки його підвищеною кислотністю, скільки тим, що при цьому утворюється внутришньокомплексні сполуки, які володіють особливою стійкістю.
Сполуки такого типу часто називають хелатними (від грецької -«хела»- клешня).
Дослід 6. Отримання диетилового ефіру.
Реактиви та матеріали: етиловий спирт 96%-й, сірчана кислота.
До сухої пробірки вводять 2 краплі етилового спирту та 2 краплі сірчаної кислоти. Суміш обережно нагрівають над полум'ям пальника до побуріння розчину. До гарячої суміші дуже обережно додають ще 2 краплі етилового спирту. Відчувається характерний запах діетиловогоефіру.
Хімізм процесу:
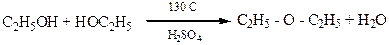
Реакція проходить у дві стадії. Спочатку спирт реагує з сірчаною кислотою, утворюючи кислий складний ефір сірчаної кислоти - етилсульфат, або етилсірчану кислот:
CH3 – CH2OH + HO – SO3H «CH3 – CH2 – OSO3H + H2O
Якщо беремо спирт у надлишку то утворюється простий ефір:
CH3 – CH2 – O - SO3H + CH3 – CH2OH ® CH3 – CH2 – O – CH2 – CH2 – CH3 + H2SO4
Якщо до реакції вступає відносно багато сірчаної кислоти та мало спирту, то при наступному нагріванні (до 160'С) утворюється олефін. Отож у залежності від температури реакцій та кількісних співвідношень спирту та сірчаної кислоти можливі два випадки дегідратації:
а) з утворенням етиленового вуглеводню (внутрішньо-молекулярна дегідратація)
б) з утворенням простого ефіру (міжмолекулярна дегідратація).
Дослід 7. Отримання фенолята натрію.
Реактиви та матеріали: фенол, насичений розчин, їдкий натр, 2н розчин.
До пробірки містять 4 краплі емульсії фенолу в воді та додають 2 краплі розчину їдкого натру. Негайно утворюється прозорий розчин феноляту натрію, т. я. він добре розчиняється у воді. Розчини залишають для наступного досліду.
Хімізм процесу:
C6H5 – OH + NaOH ® C6H5 – ONa + H2O
Феноли володіють кислотними властивостями, вони легко вступають до реакції утворень з водними лужними розчинами, утворюючи аналогічні алкоголятам феноляти.Тому найпростіший фенол назвали «карболовою кислотою». Більш міцний кислотний характер фенолів у порівнянні із спиртами пояснюється впливом бензольного ядра.
Дослід 8. Реакція фенолу з хлоридом заліза (III).
Реактиви та матеріали: фенол, насичений водний розчин, хлорид заліза, 0, 1 н розчин.
Містять до пробірки 2 краплі розчину фенолу, додають 3 краплі води та 1 краплю розчину хлориду заліза. З'являється інтенсивне червоно - фіолетове забарвлення.
Феноли з хлоридом заліза у водному розчині дають кольорову реакцію внаслідок утворення забарвленої сполуки C6H5OFeCl2 або точніше, забарвленого іону C6H5OFe2+. Ця реакція для якісного відкриття фенолів.
Заняття 7.
Альдегіди та. кетони.
Контрольні запитання.
1. Напишіть структурні формули наступних сполук:
а) ізомасляний альдегід, б) метилізобутилкетон, в) 2- метилпентаналь, г)
5,5- диметилгексанон - 3, д) 2- метилгептан-2-ОН- 4
2. Окисленням яких спиртів можна одержати: а) етил - третбутилкетон, б) 3.3- диметилбутаналь.
3. Які сполуки одержуються при сухій перегонці кальцієвих солей сумішей наступних кислот:
а) мурашиної та ізомасляної, б) пропіонової та ізовалеріанової.
Хід роботи:
Дослід 1. Кольорова реакція на альдегіди з фуксинсірчаною кислотою.
Реактиви та матеріали: формальдегід, 40 %-й водний розчин, оцтовий альдегід; фуксинсірчана кислота.
До 2 пробірок містять по 2 краплі розчину фуксинсірчаної кислоти й додають одної з них 2 краплі розчину формальдегіду, а до іншої 2 краплі оцтового альдегіду. Розчин фуксинсірчаної кислоти при доданні розчину формальдегіду поступово забарвлюється у фіолетовий колір, при доданні оцтового альдегіду - у рожево - фіолетовий колір.
Дослід 2. Альдольна конденсація.
Реактиви та матеріали: оцтовий альдегід; їдкий натр, 2н розчин.
Містять у пробірку 3 краплі оцтового альдегіду та 3 краплі розчину їдкого натру. Обережно нагрівають вміст пробірки над полум'ям пальника. Рідина поступово буріє та темніє, з являється різкий запах. Молекули альдегідів можуть поєднуватись друг із другом, утворюючи нові вуглець - вуглецеві зв'язки, відбувається взаємодія карбонільної групи однієї молекули альдегіду 3a- воднем метиленової групи іншої молекули a- водень під впливом сусідньої карбонільної групи здатен відщеплюватись у вигляді протону. Ця реакція відбувається під дією лугів і утворюється карбаніон:

Утворившись карбаніон реагує з карбонільною групою іншої молекули альдегіду (за схемою нуклеофільного приєднання).

алкоголят – іон

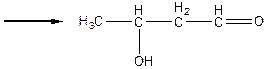
альдоль (3 – оксибутаналь)
Ця реакція називається альдольною конденсацією (реакція О.П.Бородіна). При нагріванні реакційної суміші продукт дегідрується:
Утворившись ненасичений кротоновий альдегід (бутен-2 - аль) має характерний різкий запах. При високій концентрації луги процес ущільнення йде далі і утворюються високомолекулярні забарвлені смоляні продукти.
Дослід 3. Самоокислення водних розчинів формальдегіду.
Реактиви та матеріали: формальдегід, 40 %-й водний розчин, метиловий червоний, розчин.
До пробірки містять 2- 3 краплі розчину формальдегіду та додають 1 краплю індикатору метилового червоного. Розчин приймає забарвлення, що вказує на кисле середовище.
Альдегіди дуже легко окислюються. У водних розчинах в них можуть окислюватись в кислот) за рахунок кисню іншої молекули альдегіду, відновлює її в спирт - відбувається реакція окислювального відновлення (дисмутації ).
Дослід 4. Одержання уротропіну, його гідроліз.
Реактиви та матеріали: 40 %-й водний розчин формальдегіду (формалін): аміак, 2н розчин: 1 %- й спиртовий розчин-соляна кислота. 2н розчин; фуксинсірчана кислот.
До пробірки містять і краплю розчину фенолфталеїну та 2 краплі розчину аміак). Розчин стає рожевим, від додання 1 краплі розчину формальдегіду він знебарвлюється. Додають ще 2 краплі NHОН - розчин стає рожевим, але швидко знебарвлюється, т. я. аміак вступає до реакції з формальдегідом, утворюючи гексаметилентетрамін. або уротропін. Додають по краплям розчин аміаку до виникнень незникаючого рожевого забарвлення, це вказує на те, що весь формальдегід прореагував із аміаком, і с надлишок аміаку.
Кілька крапель одержаного розчину переносять на предметне скло та обережно випаровують воду над полум'ям пальника. На склі залишаються кристали уротропіну, вони мають солодкуватий смак, та не мають запаху.
До залишку розчину уротропіну додають краплю соляної кислоти та кип'ятять при трусінні. Відчувається запах формальдегіду. У пробірку додають 2 краплі розчину фуксинсірчаної кислоти. З'являється рожеве забарвлення, яке свідчить про наявність формальдегіду.
Хімізм процесу:
4NH3 + 6CH2O «C6H12N4 + 6H2O
гексаметилентетрамін, або уротропін
Реакція утворення уротропіну обернена, але гідроліз уротропіну відбувається лише під впливом каталізатору - соляної кислоти, яка зв'язує утворений при гідролізі аміак.
Дослід 5. Окислення альдегідів аміачним розчином оксиду срібла (реакція «срібного дзеркала»).
Реактиви та матеріали: формальдегід, 40 %- й водний розчин; аміак, 2н розчин; нітрат срібла, 0,2 н розчин.
До чистої пробірки вводять 2 краплі розчину нітрату срібла та додають краплю розчину аміаку. Утворений бурий осад гідроксиду срібла розчиняють, додаючи надлишок (1-2 краплі) розчину аміаку. Потім додають краплю розчину формальдегіду і повільно підігрівають вміст пробірки над полум'ям пальника. При обережному нагріванні вміст пробірки буріє та на її стінках може виділитися срібло у вигляді сяючого дзеркального нальоту (комплексний іон металу відновлюється до металевого срібла).Альдегід окислюється до кислоти, яка утворює амонієву сіль.
Хімізм процесу:
AgNO3 + NH4OH ®AgOH + NH4NO3
2AgOH ® Ag2O + H2O
Ag2O +4NH4OH ® 2[Ag(NH3)2]OH + 3H2O
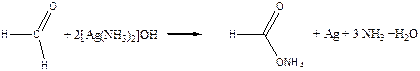
Ця реакція є якісною реакцією на альдегіди.
Дослід 6. Окислення альдегідів гідроксидом міді (II).
Реактиви та матеріали: формальдегід, 40 %- й водний розчин; сульфат міді. 0.2 її розчин; їдкий натр, 2 н розчин.
До пробірки містять 4 краплі розчину їдкого натру, розводять його 4 краплями води та додають 2 краплі розчину сульфату міді. До осаду, який випав гідроксиду міді (II) додають 1 краплю розчину формальдегіду та збовтують вміст пробірки. Нагрівають над полум'ям пальника до кипіння лише верхню частину розчину так, щоб нижня частина залишалася для контролю. У нагрітої частині пробірки виділився жовтий осад гідроксиду міді (І) СuОН, який переходить у червоний оксид міді (І) Cu2O, а іноді на стінках пробірки виділяється навіть металева мідь.
Хімізм процесу:
CuSO4 + 2NaOH ® Cu(OH)2 + Na2SO4

2CuOH ® Cu2O + H2O
Повторить цей дослід, замінивши розчин формальдегіду розчином оцтового альдегіду.
Ця реакція також е якісною реакцій на альдегіди.
Дослід 7. Одержання ацетону з оцтовокислого натрію.
Реактиви та матеріали: оцтовокислий натрій, зневоднений; соляна кислота, концентрована.
До сухої пробірки містять близька 0,1 г зневодненого оцтовокислого натрію CH3COONa (висота шару повинна бути близька 3 мм). Зачиняють пробірку пробкою з газовідвідною трубкою, нижній кінець якої опускають у пробірку з б- 8 краплями води. Тримаючи пробірку з
оцтовокислим натрієм у горизонтальному положенні, нагрівають її у полум'ї пальника. Пари ацетону конденсуються у воді, яка знаходиться у другій пробірці.Відчувається характерний запах ацетону. Після охолодження першої пробірки додають до неї краплю концентрованої соляної кислоти. Відбувається сильне шумування у наслідок виділення двоокисі вуглецю.
Хімізм процесу:

карбонат натрію
Na2CO3 + 2HCl ® CO2 + 2NaCl + H2O
Дослід 8. Окислення бензойного альдегіду киснем повітря.
Реактиви та матеріали: бензойний альдегід.
Містять на предметне скло краплю бензольного альдегіду та залишають на повітрі. Через деякий час з'являються кристали бензойної кислоти, важко розчинні у холодній воді.
Хімізм процесу:

бензальдегід надбензойна кислота бензойна кислота
Ароматичні альдегіди окислюються ще ліпше, ніж альдегіди жирного ряду, утворюючи відповідні ароматичні кислоти. Наприклад, бензойний альдегід легко окислюється до бензойної кислоти не тільки окислювачами, але і киснем повітря, особливо на світлі. В якості проміжного продукту утворюється перекисла сполука - надкислота.
Заняття 8.
Карбонові кислоти.
Контрольні запитання:
1. Скласти структурні формули всіх кислот, ізомерних валеріанової та назвіть їх за раціональною та систематичною номенклатурою.
2. Напишіть структурні формули всіх ізомерних ненасичених кислот складу C4H6O2. Назвіть їх. Для яких з цих кислот характерна геометрична ізомерія?
3. Отримайте ізомасляну кислоту та її хлорангідрид з ізобутилового спирту та необхідних неорганічних реагентів. Напишіть рівняння реакцій.
4. Наведіть приклади схем реакцій, за допомогою яких можна отримати: а) п- бром - бензойну кислоту з толуолу,
б) фталеву кислоту з о- ксилолу. Для синтезу можна використовувати будь які неорганічні сполуки.
5. Розташуйте у ряд, за зменшенням кислотних властивостей, наступні сполуки: а) о- хлорбензойна кислота,
б) бензойна кислота,
в) п-хлорбензойна кислота,
г) п- толуолова кислота,
д) п- нітробензойна кислота.
6. Напишіть рівняння реакцій, які протікають за схемою:
етилен 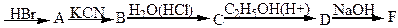
7.Сполука складу С5H10O2 взаємодіє із гідроксидом натрію з утворенням речовини C5H7O2, яка при нагріванні з натровим вапном дає 2- метилпропан. Встановить будову цієї сполуки.
Хід роботи:
Дослід 1. Одержання бензойного калію.
Реактиви та матеріали: бензойна кислота; їдке калі, 1 н розчин; соляна кислота, 1 н розчин.
До пробірки містять кілька кристалів бензойної кислоти та додають З краплі розчину їдкого калі. Трясуть вміст пробірки. Кристали розчиняються.
Хімізм процесу:
C6H5COOH + KOH ® C6H5COOK + H2O
Бензойна кислота з основами утворює солі, її солі з лужними металами добре розчинні у воді, тому бензойна кислота розчинна у лугах. До отриманого прозорого розчину бензойнокислого калію додають 2- З краплі розчину соляної кислоти. Знову випадає бензойна кислота:
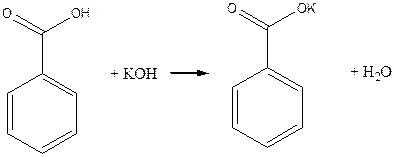
Дослід 2. Окислення мурашиної кислоти перманганатом калію.
Реактиви та матеріали: мурашинокислий натрій; сірчана кислота, 2н розчин; перманганат калію. 0,1 н розчин; баритова вода, насичений розчин.
До пробірки містять кілька крупинок мурашинокислого натрію, додають 2 краплі розчину перманганату калію та 3 краплі розчину сірчаної кислоти. Отвір пробірки зачиняють пробкою з газовідвідною трубкою, кінець якої опускають до пробірки з баритовою водою. Вміст пробірки нагрівають у полум'ї пальника. Через декілька секунд рожевий розчин знебарвлюється, а баритова вода у другій пробірці мутнішає.
Хімізм процесу:

CO2 + Ba(OH)2 ® BaCO3 + H2O
Мурашина кислота на відміну від інших карбонових кислот легко окислюється.
Дослід 3. Одержання натрієвої солі щавлевої кислоти.
Реактиви та матеріали: мурашинокислий натрій, кришталевий -, хлорид кальцію, 0,1 розчину.
До сухої пробірки містять кілька крупинок мурашинокислого натрію та сильно нагрівають на полум'ї пальника. Плавлена сіль розкладається з виділенням водню. Вмісту пробірки дають охолонути, додають до сплаву 3-4 краплі води та злегка нагрівають до появи прозорого розчину. До іншої пробірки містять кілька крупинок мурашинокислого натрію та додають 3-4 краплі води. В обидві пробірки додають по 1 краплі розчину хлориду кальцію. У першій пробірці (щавлевокислим натрієм) утворюється білий осад, який не розчиняється у воді, кальцієвої солі щавлевої кислоти. У пробірці з розчином мурашинокислого натрію осаду не отримаємо, так як кальцієва сіль мурашиної кислоти розчинна у воді.
Хімізм процесу:

оксалат натрію

оксалат кальцію
2H – COONa + CaCl2 ® (H – COO)2Ca + 2NaCl
Одержання щавлевої кислоти швидким нагріванням форміату до 420'С є сучасним промисловим засобом її одержання.
Дослід 4. Розкладання щавлевої кислоти при нагріванні з концентрованою сірчаною кислотою.
Реактиви та матеріали: щавлева кислота, кришталева; сірчана кислота (d= 1,84г/ см); баритова вода, насичений розчин.
До пробірки містять кілька кристалів щавлевої кислоти та додають 2 краплі сірчаної кислоти. Пробірку зачиняють пробкою з газовідвідною трубкою та нагрівають на полум'ї пальника. Підпалюють виділений газ - він горить блакитним полум'ям зі спалахами. Після цього кінець газовідвідної трубки опускають у баритову воду. Баритова вода мутнішає.
Хімізм процесу:
HOOC – COOH 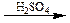 CO +CO2 + H2O
CO +CO2 + H2O
CO2 + Ba(OH)2 ® BaCO3 + H2O
Під дією концентрованої сірчаної кислоти щавлева кислота, на відміну від інших двохосновних кислот, розкладається.
Дослід 5. Одержання оцтовоетилового ефіру.
Реактиви та матеріали: Оцтовокислий натрій, зневоднений; етиловий спирт, сірчана кислота (d = 1,84 г/ см).
До сухої пробірки містять декілька порошку зневодненого оцтовокислого натрію (висота шару повинна бути 1-1,5 мм) та 3 краплі етилового спирту. Додають 2 краплі концентрованої сірчаної кислоти та обережно нагрівають над полум'ям пальника. Незабаром з'являється характерний запах оцтовоетилового ефіру.
Найважливіший засіб одержання складних ефірів - взаємодія карбонових кислот з спиртами (реакція етерифікації). В якості каталізаторів звичайно застосовують концентровану сірчану кислоту.
Хімізм процесу:

Дослід 6. Одержання бензойноетилового ефіру.
Реактиви та матеріали: бензойна кислота; етиловий спирт, сірчана кислота
(d = 1,84 г/ см).
До пробірки містять кілька кристалів бензойної кислоти, додають 4 краплі етилового спирту та 2 краплі сірчаної кислоти. Вміст пробірки трусять та обережно нагрівають до кипіння. Виливають отриману безкольорову рідину у пробірку з холодною водою. Відчувається характерний запах бензойноетилового ефіру (етилбензоату). Частина бензойної кислоти, яка не ввійшла до реакції, випадає в осад.
Хімізм процесу:
C6H5COOH + C2H5OH «C6H5 –COOC2H5 + H2O
Дослід 7. Визначення ступеню ненасиченості жиру (взаємодія жирів з бромною водою).
Реактиви та матеріали: рослинна олія; твердий жир; бромна вода, насичений розчин; етиловий ефір (або хлороформ).
Беруть 2 пробірки: до однієї з них вносять 1 краплю олії, до іншої - 1 кралю плавленого жиру. У обидві пробірки додають по 3- 5 крапель етилового спирту або хлороформу до розчинення жиру, а потім приливають з бюретки бромну воду, ретельно збовтуючи вміст пробірок. Бромну воду приливають до тих пір, доки не Уявиться стійке жовте забарвлення. Визначають скільки мл бромної води витрачено на бромування твердого та рідкого жиру. Роблять висновок про ступень ненасиченості узятих жирів.
Хімізм процесу:
CH2 – O – CO(CH2)7 – CH = CH – (CH2)7 – CH3
CH2 – O – CO(CH2)7 – CH = CH – (CH2)7 – CH3 + 3Br2 ®
CH2 – O – CO(CH2)7 – CH = CH – (CH2)7 – CH3
CH2 – O – CO(CH2)7 – CHBr - BrCH – (CH2)7 – CH3
® CH2 – O – CO(CH2)7 – CHBr - BrCH – (CH2)7 – CH3
CH2 – O – CO(CH2)7 – CHBr - BrCH – (CH2)7 – CH3
Дослід 8. Окислення рослинних олій перманганатом калію.
Реактиви та матеріали: рослинна олія; перманганат калію, 0,1 н розчин; карбонат натрію, 2 н розчин.
До пробірки містять 2 краплі олії (сонячної), 2 краплі розчину карбонату натрію та 2 краплі водного розчину перманганату калію. Трусять вміст пробірки. Малинове забарвлення перманганату калію зникає, що вказує на окислення гліцеридів ненасичених вищих кислот, які входять до складу олії.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1872; Нарушение авторских прав?; Мы поможем в написании вашей работы!