
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методичні вказівки 3 страница
|
|
|
|
Хімізм процесу:
CH2 – O – CO(CH2)7 – CH = CH – (CH2)7 – CH3
CH2 – O – CO(CH2)7 – CH = CH – (CH2)7 – CH3 + 3[O] +3HOH ®
CH2 – O – CO(CH2)7 – CH = CH – (CH2)7 – CH3
CH2 – O – CO(CH2)7 – CHOH - OHCH – (CH2)7 – CH3
® CH2 – O – CO(CH2)7 – CHOH - OHCH – (CH2)7 – CH3
CH2 – O – CO(CH2)7 – CHOH - OHCH – (CH2)7 – CH3
Дослід 9. Утворення акролеїну при розкладанні жиру.
Реактиви та матеріали: рослинна олія; вершкове масло; гідросульфат калію, кришталевий.
До сухої пробірки містять 2 -3 кристали гідросульфату калію KHSO4 (або натрію) та 1 краплю рідкого жиру або шматочок твердого жиру. Пробірку злегка нагрівають при трусінні, після цього, тримаючи пробірку горизонтально, нагрівають суміш над полум'ям пальника сильніше. Суміш чорніє, виділяються пари води та інші летучі продукти. Відчувається різкий характерний запах акролеїну:
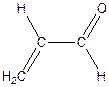
Дослід 10. Видалення вільних жирних кислот з мила.
Реактиви та матеріали: мило, концентрований розчин; сірчана кислота, 2 н розчин.
До пробірки містять 5 крапель концентрованого розчину мила, додають 1 краплю розчину сірчаної кислоти та злегка підігрівають вміст пробірки у полум'ї пальника. Спливає білий маслянистий шар вільних жирних кислот, водний розчин освітлюється. Вміст пробірки залишають.
Хімізм процесу:
C17H35 – COONa + H2SO4 ® C17H35 – COOH + NaHSO4
стеаринова кислота
Мила - солі вищих насичених та ненасичених органічних кислот. Тверде мило - суміш натрієвих солей пальмітинової, стеаринової та олеїнової кислот.
Заняття 9.
Аміно -. діазо - та азо сполуки.
Контрольні запитання:
1. Напишіть структурні формули всіх ізомерних амінов складу C4H11N. Назвіть їх за історичною та систематичною номенклатурою, вкажіть серед них первинні, вторинні та третинні аміни.
2.Наведить структурні формулі ізомерних ароматичних амінів складу C7H9N та назвіть їх.
3. Напишіть рівняння реакції одержання із етилену наступних амінів: а) етиламіну; б) пропіламіну; в) триетиламину; г) етилпроламину.
4. Напишіть рівняння реакцій одержання речовин, які протікають за схемою:
2 – метил – 1 – пропен 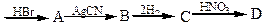
5. Встановить будову речовини складу С5H13N, яка із соляною кислотою; утворює сіль C5H14NCl, з азотною кислотою взаємодіє з виділенням азоту та утворенням речовини складу С5Н12O, яке при окисленні дає кетон, а за більш жорстких умов окислюється до оцтової та пропіонової кислот.
6. Із якої маси нітробензолу можна одержати 182 г аніліну, якщо вихід останнього становить 78%?
7. Напишіть рівняння реакцій, які відбуваються за схемою:
п-нітрогліцерин 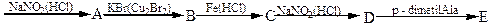
Назвіть одержанні продукти.
8. За допомогою яких хімічних реакцій можна одержати ізомерні аміни:
а) толуїдин; б) бензиламін; в) N метиланілін? Напишіть рівняння цих реакцій.
Хід роботи.
Дослід 1. Одержання метиламіну.
Реактиви та матеріали: амід оцтової кислоти; хлорне вапно; натронне вапно; гашене вапно; лакмус червоний.
а) 3 аміду оцтової кислоти до пробірки з газовідвідною трубкою, зогнутою під прямим кутом., містять 1г оцтової кислоти, додають З г суміші, склад якої: хлорне (2г) та гашене вапно (1г) та нагрівають. Утворений газоподібний метиламін відводять до іншої пробірки з холодною дистиляційною водою. Видалення метиламіну визначають за його характерним запахом та за синінням червоного лакмусового паперу.
Хімізм процесу:
Ca(OCl)2 + 2H2O ® Ca(OH)2 + 2HOCl
CH3 – CO – NH2 + HOCl ® CH3NH3 + CO2 + HCl
Розчин зберігають для наступних дослідів.
б) 3 солянокислого метиламіну. До пробірки з газовідвідною трубкою містять 1 г солянокислого метиламіну, добре змішують з подвійною кількістю натронного вапна, та суміш нагрівають.
Утворений газоподібний метиламін підпалюють біля отвору газовідвідної трубки. Метиламін добре горить на повітрі.
Якщо піднести червоний лакмусовий папір, змочений водою, до отвору газовідвідної трубки, то лакмус синіє. Паличка, змочена концентрованою соляною кислотою, обгортається димом внаслідок утворення солі з метиламіну та соляної кислоти.
Хімізм процесу:
[CH3NH3]Cl + NaOH ® CH3NH2 + NaCl + H2O
CH3NH2 + HOH ® [CH3NH3]+OH-
CH3NH2 + HCl ® [CH3NH3]+Cl-
Дослід 2. Реакція первинних аміносполук жирного ряду з азотистою кислотою.
Реактиви та матеріали: первинний амін; натрій азотистокислий, 10% розчин; оцтова кислота, концентрована.
У пробірці змішують 1г солі первинного аміну з 5мл води та 5 мл 10% розчину азотистокислого натрію. До суміші додають декілька крапель концентрованої оцтової кислоти. Спостерігають численні виділення бульбашок азоту:
CH3 - NH2 + HONO ® N2 + H2O + CH3OH
Дослід 3. Ізонітрильна реакція з метіламіном та аніліном.
Реактиви та матеріли: анілін, метиламін, гідроксид калію, спиртовий розчин, хлороформ, соляна кислота-концентрована.
Первинні аміні як жирного, так і ароматичного ряду з хлороформом у присутності лугу утворює ізонітрили:
CH3NH2 + CHCl3 + 3KOH ® CH3 – N = C + 3KCl + 3H2O
C2H5NH2 + CHCl3 + 3KOH ® C6H5 – N = C + 3KCl + 3H2O
Дослід проводять паралельно з метиламіном та аніліном. До однієї пробірки наливають 0,5 мл розчину метиламіну, отриманого у досліді 1, а до іншої декілька крапель аніліну. До вмісту кожної пробірки додають по 2мл спиртового розчину їдкого калію, 2-3 краплі хлороформу та суміш нагрівають. При цьому утворюється ізонітрил, який легко впізнати за характерним, досить неприємним запахом. По закінченню досліду ізонітрил треба зруйнувати доданням до охолодженого розчину 3-4 мл концентрованої соляної кислоти, або розбавленої 104 сірчаної кислоти, у присутності якої ізонітрили гідролізуються у первинні аміни:
CH3 – N = C + 2HOH ® CH3NH2 + H - COOH
C6H5 – N = C + 2HOH ® C6H5NH2 + H - COOH
Дослід 4. Досліди з аніліном.
Реактиви та матеріали: анілін, водний розчин; хлорне вапно, водний розчин; хромова суміш; бромна вода; соляна кислота, 10% розчин; сірчана кислота, 10% розчин; формальдегід; оцтовий ангідрид.
а) Реакція аніліну з хлорним вапном. Водний розчин аніліну з хлорним вапном дає характерне фіолетове забарвлення. До кількох мл водного розчину додають декілька крапель профільтрованого водного розчину хлорного вапна. Спостерігають виникнення фіолетового забарвлення, яке переходить у грязно-фіолетове. Цю досить чутливу реакцію дають тільки1 водні розчини вільного аніліну, але не його солей.
б) Реакція аніліну з хромовою сумішшю. До кількох мл водного розчину <v аніліну додають кілька крапель хромової суміші (суміш концентрованої; сірчаної кислоти та двохромокислого натрію або калію). Внаслідок реакції окислення спостерігають появу синьо - чорного, або зелено -, чорного забарвлення, яке переходить в явне чорне забарвлення. При цьому утворюється аніліновий чорний фарбник
в) Взаємодія аніліну з бромною водою. До 2- 3 мл водного розчину > аніліну додають по краплям бромну воду. Спостерігається зникнення забарвлення бромної води та виникнення білого нерозчинного у воді осаду триброманіліну:
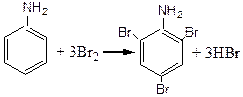
Ця реакція знаходить широке використовування при кількісному визначенні вмісту аніліну у розчині.
г) Взаємодія аніліну з мінеральними кислотами. У 2 пробірки наливають по 2- 3 мл аніліну. До одної додають 10 % соляної кислоти, до іншої -10% сірчаної кислоти. У першій пробірці утворюється прозорий розчин солянокислого аніліну, т. я. утворена сіль добре розчинна у воді:
C6H5NH2 + HCl ® C6H5NH2 · HCl або [C6H5NH3]+Cl-
У другій пробірці випадає білий осад важкорозчинної кислої сірчаної солі аніліну:
C6H5NH2 + HOSO2OH ® C6H5NH5 · HOSOH або [C6H5NH3]+OSO2OH-
д) Реакція аніліна з лігніном. Анілін з лігніном у присутності соляної дає характерне яскраво - жовте забарвлення. Лігнін входе до складу деревини та міститься у низькоякісних сортах звичайного паперу. В пробірці готують розчин солянокислого аніліну, додаючи до 1- 2 мл аніліну соляну кислоту. У розчин одержаного солянокислого аніліну опускають соснову скіпку або смужку звичайного газетного паперу. Спостерігають пожовтіння скіпки або паперу. З фільтрувальним папером забарвлення не спостерігається.
е) Реакція конденсації аніліну з формальдегідом. Анілін легко вступає до реакції конденсації з формальдегідом за звичайних умов:
C6H5NH2 + H – CO – H ® C6H5N = CH2 + H2O
До пробірки наливають 2 - 3 мл водного розчину аніліну і таку ж кількість розчину формальдегіду (формаліну). При ретельному збовтуванні спостерігається поступове утворення білого осаду - основа Шифа.
ж) Реакція ацілірування. У пробірці змішують 3 мл води та 1 мл аніліну, добре перемішують, після чого додають 1 мл оцтового ангідриду та Й знов збовтують. Після цього обережно нагрівають до кипіння та вміст виливають до іншої пробірки з 5- б мл води. Спостерігається випадіння кришталевого осаду ацетаніліду:
C6H5NH2 + (CH3 – CO)2O ® C6H5NHCOCH3 + CH3 - COOH
Ацетанілід раніш використовувався у медицині під назвою антіфебріна у якості жарознижуючого засобу, а також використовувався для синтезу білого стрептоциду, п- нітроаніліна та інших сполук.
Дослід 5. Одержання анілінформальдегідної смоли.
Реактиви та матеріали: анілін; формалін, 35- 40% розчин; оцтова кислота, 80% розчин.
Анілінформальдегідні смоли одержують поліконденсацією первинних ароматичних амінів та їx похідних з формаліном.
У невеличкий хімічний стаканчик містять 3- 4 мл аніліну, 3 мл 35- 40 % формаліну та 0.5- 0,7 мл 80% оцтової кислоти. Через 1- 2 хв., за звичайних температур виходить біла аморфна маса, яка являє собою тример метилен аніліну. Утворення тримеру метіленаніліну можна зобразити у 3 стадії:
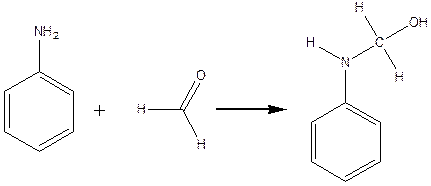
N – метилоланілін
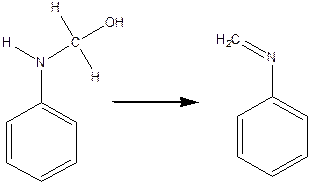
N – метиленанілін
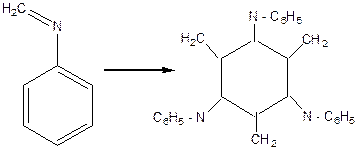
тример метиленаніліну
Для того, щоботримати смолу з білого порошку тримеру метиланіліну, його промивають водою, висушують між листям фільтрованого паперу, містять до сухої пробірки, приливають 2-3 мл 80% оцтової кислоти та нагрівають кілька хвилин до утворення густої жовтої маси. При цьому тример метиланіліну переходить у полімер метиланіліну:
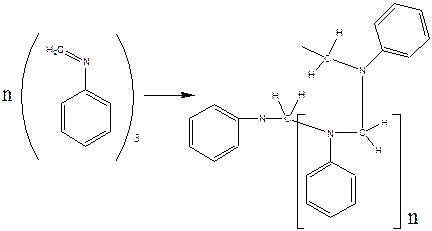
тример метиленаніліну полімер метиленаніліну
Одержану смолу з білого порошку виливають на папір, або скло. Смола швидко твердіє у жовту ломку склоподібну масу. Анілінформальдегідна смола розчиняється у суміші спирту та бензолу.
Дослід 6. Реакція діазотірування.
Реактиви та матеріали: соляна кислота, 10% розчин, азотистокислий натрій, 10% розчин; крига; йод - крохмальний папір.
У невеличкій конічній колбі готують розчин солянокислого аніліну з 1 мл аніліну та 1 мл 10% соляної кислоти до повного розчинення аніліну. Розчин охолоджують у кристалізаторі сумішшю води зі снігом або товченою кригою до температури 5*С.Не виймаючи колби з охолоджувальної суміші, приливають по краплям, при постійному змішуванні, із крапельної воронки 1,5-2 мл 10% розчину азоткислого натрію. Кінець реакції впізнають за синінням йодкрохмального паперу, на який наносять скляною паличкою краплю реакційної суміші:
C6H5NH2 + HCl ® [C6H5NH3]+Cl-
[C6H5NH3]+Cl- + NaONO + HCl ® [C6H5 – N º N]+Cl- + 2HOH
хлористий фенілдіазоній
У надлишку азотистої кислоти виділяється вільний йод. внаслідок чого крохмаль забарвлюється у синій колір. Отриманий розчин зберігати до наступних дослідів.
Дослід 7. Реакція азотсполучення. Одержання азотфарбники
Реактиви та матеріали: диметиланілін; соляна кислота, 10% розчин, оцтовокислий натрій, насичений розчин; гідроксид натрію, 10% розчин; фенол; нафтол.
а) Одержання анілінового жовтого(диметиламіноазобензолу).
До пробірки наливають 0,5 мл диметіланіліну, 3- 4 мл води та по краплям 10% соляної кислоти до повного розчинення. Суміш охолоджують та додають 3- 4 мл розчину солі хлористого фенілдіазонію, отриманого у досліді 6, а потім 2- 3 мл насиченого розчину оцтовокислого натрію. При збовтуванні суміші, при достатньої кількості оцтовокислого натрію виділяється диметіладіноазобензол у вигляді жовтого осаду.
Оцтовокислий натрій у даній реакції необхідний для нейтралізації соляної кислоти, т. я. у сильно кислому середовищі реакція азотсполучення не відбувається.
Хімізм процесу:
[C6H5 – N º N]+Cl- + C6H5N(CH3)2 ® 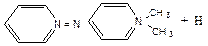
б) Одержання аніліну оранжевого із фенолу та нафтолу.
У 2 пробірках окремо розчиняють у 2- 3 мл 10% розчину їдкого натрію по 0,2 г фенолу та нафтолу. До пробірки з розчином фенолу додають 1- 2 мл розчину хлористого фенілдіазонію. Фенол при сполученні з фенілдіазонієм дає параоксіазобензол оранжевого кольору:
[C6H5 – N º N]+Cl- + C6H5OH 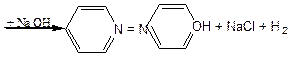
До пробірки з розчином b - нафтолу також додаємо 1-2мл розчину хлористого фенілдіазонію b - нафтол, взаємодіє з фенілдіазонієм, утворює a - фенілазо – b - нафтол - фарбник (судан -1) у вигляді оранжевого осаду.
Хімізм процесу:
[C6H5 – N º N]+Cl- + 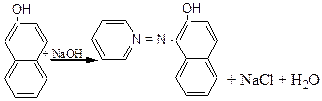
Дослід 8. Якісна реакція на дифеніламін.
Реактиви та матеріали: дифеніламін; сірчана кислота концентрована, азотна кислота, розчинена
До пробірки містять кілька кристалів дифеніламіну, додаючи близько 1 мл концентрованої сірчаної кислоти та 1 краплю сильно розчиненого розчину азотної кислоти.
Спостерігається виникнення синього забарвлення завдяки окисленню дифеніламіну у тетрафенілгідразін, який з концентрованою сірчаною кислотою дає сине забарвлення. Ця реакція широко використовується в аналітичній хімії для відкриття іону NO3
Хімізм процесу:
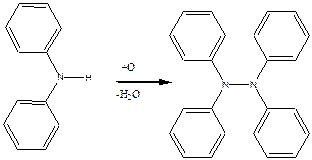
Заняття 10.
Амінокислоти та білки.
Контрольні запитання:
1. Напишіть структурні формули ізомерних амінокислот складу C3H7O2N. Назвіть їх за раціональною та систематичною номенклатурою. Вкажіть які з них є оптично активні, відобразіть їх проекційні формули
2. Оцтовий альдегід був оброблено HCN(KCN + НСl). Отримана сполука після взаємодії з аміаком була піддана кип'ятінню з розбавленою соляною кислотою. Яка речовина утворюється у наслідку вказаних перетворень? Напишіть рівняння реакцій.
3. Напишіть рівняння реакцій взаємодії - аміномасляної кислоти з наступними речовинами: а) йодметаном, б) азотистою кислотою, в) соляною кислотою, г) оцтовим ангідридом, д) їдким калі, е) гідроксидом міді (11), Як поводиться ця кислота при нагріванні.
4. Встановити будову речовини складу C4H9O2N, знаючи, що вона розчиняється у лугах та кислотах, при реакції з азотистою кислотою виділяє азот, з метаном дає речовину складу C4H9O2N, а при нагріванні виділяє аміак та утворює речовину складу C3H4O2, яка виявляє кислотні властивості.
5. Напишіть структурні формули проміжного та кінцевого продуктів у схему:
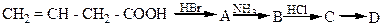
6. Скільки мл 10% розчину гідроксиду натрію (r = 1,1 г/ см) необхідно для нейтралізації амінооцтової кислоти, одержаної з 3,2 г карбіду кальцію?
Хід роботи:
Дослід 1. Відношення амінокислот до індикаторів.
Реактиви та матеріали: амінооцтова кислота. 0,2 н розчин; метиловий оранжевий, розчин; метиловий червоний, розчин; лакмус, розчин
До пробірки містять 2 краплі розчину амінооцтової кислоти та додають 1 краплю метилового оранжевого. Такій же дослід проводять з метиловим красним та лакмусом. Забарвлення індикаторів не змінюється.
Амінокислоти володіють як кислотними, так й основними властивостями; кислотна група -СООН та основна – NH2 взаємно нейтралізуються, отже амінокислоти мають структуру амфотерних, або біполярних, іонів (внутрішні солі): H3N – CH2 – COO-
Тому водні розчини одноосновних моноамінокислот нейтральні за відношенням до індикаторів.
Дослід 2. Утворення мідної солі амінооцтової кислоти.
Реактиви та матеріали: амінооцтова кислота, 0.2 н розчин; оксид міді (II) СuO, порошок; їдкий натр, 2 н розчин.
До пробірки містять трохи порошку оксиду міді СuО, 4 краплі розчину амінооцтової кислоти та нагрівають у полум'ї пальника, трусять вміст пробірки. Пробірку ставлять на деякий час у штатив, щоб осів надлишок чорного порошку оксиду міді. До відстояного синього розчину приливають 1 краплю розчину їдкого натру.
Для амінокислот характерне утворення мідних солей, забарвлених у синій колір a - амінокислоти дають з міддю забарвлені внутрішні комплексні солі, дуже стійки:
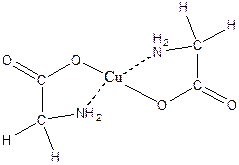
Зв'язок між атомами міді та азоту координаційний за рахунок вільної пари електронів азоту аміногрупи.
Дослід 3. Дія мурашиного альдегіду на кислоти.
Реактиви та матеріали: амінооцтова кислота, 0.2 н розчин; формальдегід, 40% розчин; метиловий червоний, розчин.
До пробірки містять 3 краплі розчину формальдегіду та 12 краплю метилового червоного. І-за дисмутації мурашиного альдегіду розчин забарвлюється у червоний колір. За допомогою піпетки з капілярним отвором приливають по краплям розчин луги до виникнення жовтого забарвлення (нейтральне середовище на метиловий червоний).
До окремої пробірки містять 3 краплі амінооцтової кислоти та приливають до неї вміст першої пробірки. Водночас виникає червоне забарвлення:
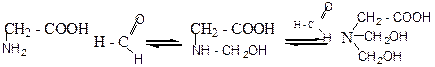
Блокована мурашиним альдегідом аміногрупа не впливає на карбоксил, і розчин амінокислоти придбає кислу реакцію.
Дослід 4. Дія азотистої кислоти на амінокислоти.
Реактиви та матеріали: нітрит натрію, 1 н розчин, (свіжо приготовлений); амінооцтова кислота, 0,2 н розчин; соляна кислота, 2 н розчин.
До пробірки містять 2 краплі розчину амінокислоти, 2 краплі розчину нітрату натрію та 2 краплі соляної кислоти. При трусінні вмісту пробірки виділяються бульбашки газу.
Хімізм процесу:

оксиоцтова кислота
На цій реакції основане кількісне визначення аміногруп у амінокислотах, а також у білках та продуктах їх розпаду. Виділяється азот, який визначається об’ємним методом.
Дослід 5. Характерні якісні реакції на білкові речовини.
Реактиви та матеріали: білки, водні розчини; сульфат міді, 5% розчин; оцтовокислий свинець, 5% розчин; хлорид ртуті, 5% розчин; азотна кислота, концентрована; сірчана кислота, концентрована; соляна кислота, концентрована; сульфат амонію, насичений розчин; їдкий натр, 10% розчин; 2% розчин мідного купоросу.
а) Коагуляція білків при нагріванні. До пробірки обережно наливають З - 4 мл свіжо приготовленого розчину яйцевого білку та обережно нагрівають на полум'ї пальника. Спостерігають поступове помутніння розчину та утворення осаду білка. Коагуляція білків при нагріванні - процес незворотній.
б) осаджування білків солями важких металів. До 3 пробірок наливають і по 1 - 2 мл досліджуваного розчину білка та повільно, по краплям, додають до першої - пробірки 5% розчин сірчанокислої міді, до другої 5% розчин оцтовокислого свинцю, до третьої - 5% розчин хлорної ртуті. У всіх трьох пробірках спостерігається утворення пластівцевого осаду. При надлишку реактивів осад знов розчиняється.
в) осаджування білків мінеральними кислотами. До 3 пробірок наливають по 1- 2 мл концентрованих кислот - азотної, соляної, сірчаної. До кожної з них обережно по стінам наливають по 1 мл розчину білка па межі кислота - білок спостерігають утворення білого осаду білка. При збовтуванні сумішей у випадку надлишку соляної та сірчаної кислот осади білка розчиняються, відтоді як у азотній кислоті розчинення не спостерігається.
г) Виселення білків. До розчину білка у пробірці додають насичений розчин сірчанокислого амонію. Спостерігається помутніння та випадає осад. При доданні води осад білка знов розчиняється.
д) Кольорові реакції на білок. Ксентопротеінова реакція. З- 5 мл розчину яйцевого білка нагрівають з 1- 2 мл концентровано! азотної кислоти. При цьому випадає осад жовтого кольору. Жовте забарвлення зумовлено нітруванням ароматичних груп білкових молекул. При доданні аміаку до охолодженого розчину, жовтий колір переходить у оранжевий. Ксантопротеінова реакція зумовлена наявністю у білках залишків таких ароматичних амінокислот, як фенилаланин, тирозин, триптофан. Біоретова реакція. У пробірці 3 мл розчину яйцевого білка нагрівають з 2 мл 10% розчину їдкого натру та декілька краплями 2% розчину мідного купоросу. При цьому рідина забарвлюється у характерний червоно - фіолетовий колір.
Біоретова реакція зумовлена наявністю у молекулі білка пептидних угруповань -СО - NH -.
Реакція на наявність сірки у білку. До пробірки наливають 0,5 мл 1 % розчину оцтовокислого свинцю та по краплям додають 10 % розчин їдкого натру до розчинна утвореного гідрату окисі свинцю. До розчину додають кілька крапель білка або 2- 3 мл розчину білка. Суміш змішують та обережно нагрівають до кипіння упродовж 2- 3 хв. Виникнення бурого, а під кінець реакції чорного забарвлення вказує на утворення сірчистого свинцю, отже на наявність сірки у досліджуємої білкової речовини.
Заняття 11.
Оксикислоти.
Контрольні запитання:
1. Назвіть наступні сполуки:
а) 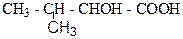 б)
б) 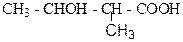
в) 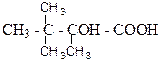
г) 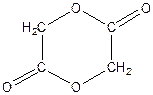 д)
д) 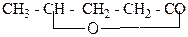 е)
е) 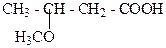
2. Які з наступних сполук можуть мати оптичні ізомери:
а) CH3 – CH2 – CH2 – CH2OH б) CH3 – CH2 – CHOH – CH3
в) HO –CH2 - CHOH –CНО г)НООС – СН2 - СНВг-СООН
3. Напишіть формули оптичних ізомерів для бутандиолу - 2,3 та пентадіолу - 2,3. Вкажіть оптично неактивні, які обставини цього?
4. Напишіть рівняння реакцій взаємодії формальдегіду, ізомасляного альдегіду метилбутанолу, 4 метилгексанолу- 3 з синильною кислотою. Проведіть гідроліз продуктів приєднання. Назвіть одержанні сполуки.
5. З пропіонового альдегіду через продукт альдольної конденсації отримайте 2- метил 3- оксипентанову кислоту. Напишіть рівняння реакції взаємодії з:
а) оцтовим ангідридом,
б) етиловим спиртом у присутності сірчаної кислоти.
6. Напишіть формули всіх сполук отриманих внаслідок реакції за схемою:
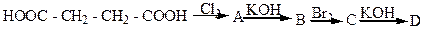
Вкажіть які просторові ізомери можливі для кожної з цих сполук. Чи відбувається процес стеріонаправлено та чи одержуються у даному випадку суміш всіх теоретично можливих стереоізомерів?
Хід роботи:
Дослід 1. Якісна реакція a - оксикислот з хлоридом заліза.
Реактиви та матеріали: хлорі заліза (111), 0,1 н розчин; фенол, водний розчин; молочна кислота, оцтова кислота, концентрована.
У 2 пробірки вводять по 2 краплі розчину хлориду заліза та додають по 2 краплі розчину фенолу. Розчини забарвлюються у фіолетовий колір. До однієї з пробірок додають 2 краплі молочної кислоти, а до іншої - стільки же крапель оцтової кислоти.
У пробірці з молочною кислотою з являється зеленувато - жовте забарвлення, у пробірці з оцтовою кислотою колір розчину не змінюється.
a- оксикислоти витісняють фенол з комплексного феноляту і фіолетове забарвлення розчину переходить в жовте. У присутності молочної кислоти фіолетовий колір залізного комплексу змінюється на зеленувато - жовтий у наслідок утворення лактату заліза
(молочнокислого заліза):
CH3 – CH(OH) – COOH + FeCl3 ® [CH3 – CH(OH) – COO]3Fe + 3HCl
молочнокисле залізо
Ця реакція викликає великий інтерес та використовується у клінічній практиці для визначення молочної кислоти (як патологічного продукту) у шлунковому соку.
Дослід 2. Відкриття молочної кислоти у молочній сироватці.
Реактиви та матеріали: кисла сироватка (від кислого молока або сиру); хлорид заліза (111), 0,1 н розчин; фенол, 5% розчин.
До пробірки містять краплю розчину хлориду заліза та додають 1-2 краплі розчину фенолу до виникнення фіолетового забарвлення. Потім додають 2 краплі сироватки. З'являється зелено - жовте забарвлення. Кисла молочна сироватка дає реакцію з хлорним залізом, т. я. вона
містить вільну молочну кислоту.
Дослід 3. Розкладення молочної кислоти сірчаною кислотою.
Реактиви та матеріали: молочна кислота; сірчана кислота, концентрована; фуксинсірчана кислота, насичений розчин.
1. До сухої пробірки містять 2 краплі молочної кислоти, додають 2 краплі сірчаної кислоти та нагрівають над полум’ям пальника до кипіння. Виділений газ (оксид вуглецю) підпалюють, він горить блакитним полум’ям. - оксикислоти при нагріванні з розбавленою сірчаною кислотою відщеплюють мурашину кислоту, перетворюючи у альдегід або кетон, який містить на 1 атом вуглецю менш, ніж похідна оксикислота:
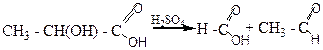
молочна кислота мурашина кислота ацетальдегід
У присутності сірчаної кислоти замість мурашиної кислоти утворюється продукт її дегідратації - оксид вуглецю:
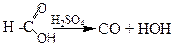
Ця реакція служить для відкриття a- оксикислот.
2. До пробірки містять 2 краплі води, краплю сірчаної кислоти та краплю молочної кислоти. Зачиняють пробірку пробкою з газовідвідною трубкою, кінець якої опускають до пробірки, яка містить 1 мл води та 2- 3 краплі фуксинсірчаної кислоти. Суміш молочної та сірчаної кислот нагрівають до кипіння. фуксинсірчаиа кислота забарвлюється у рожево - фіолетовий колір у наслідок утворення альдегіду.
Дослід 4. Кольорова реакція саліцилової кислоти з хлоридом заліза.
Реактиви та матеріали: саліцилова кислота, насичений розчин; хлорид заліза FeCl3 0,1 н розчин; етиловий спирт, 96% - й.
До пробірки вводять 2 краплі розчину саліцилової кислоти та додають 1 краплю розчину хлориду заліза. Розчин забарвлюється у темно-фіолетовий колір, що вказує на наявність у саліциловій кислоті фенольного гідроксилу. Додають до розчину 4 краплі етилового спирту, забарвлення не зникає (на відміну від фенолу).
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1639; Нарушение авторских прав?; Мы поможем в написании вашей работы!