
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методичні вказівки 4 страница
|
|
|
|
Заняття 12.
Галогенпохідні.
Контрольні запитання:
1. Назвіть сполуки за міжнародною номенклатурою ІЮПАК:
а) 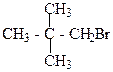 б)
б) 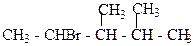 в)
в) 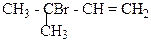
г) 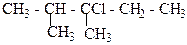 д)
д) 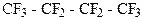 е)
е) 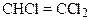
2. Напишіть рівняння реакцій взаємодії 2- метил - 2,4- діхлорбутану з спиртовим розчином луги, з водним розчином луги.
3. Напишіть схеми одержання:
а) 2- бром - 3- метилбутану з бромистого ізоамилу
б) бромистого втор - бугилу з бромистого бутилу,
в) 2-.метил- 2- хлорбутану з 2- метилбутану - 1
г) 1,2- дихлоретану з етилового спирту.
4. Отримайте будь яким засобом хлористий ізобутил. Напишіть рівняння реакцій його взаємодії з: а) ціаністим калієм, б) аміаком, в) етілатом натрію, г) спиртовим та водним розчином луги.
Використовуючи ацетилен та неорганічні реагенти, отримайте:
а) хлористий вініл, б) хлористий етиліден.
6. Виходячи з органічного галогеніду запропонуйте метод синтезу наступних сполук:
а) C6H5OCH2CH3
б) C6H5C = CCH3
в) 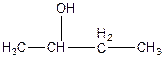
7.Проведіть нітрування сполук: а) хлорбензолу, б) нітробензолу в) фенолу, г) етилбензолу, д) бензойної кислоти, е) о- нітробензолу.
8. При взаємодії суміші етилового спирту та фенолу з надлишком бромної води видалилося 33,1 г осаду. Така ж кількість сумішей може прореагувати з 13,8 г металевого натрію. Який похідний склад суміші у грамах?
Хід роботи:
Дослід 1. Одержання бромистого етилу.
Реактиви та матеріали: етиловий спирт, бромід калію (порошок); сірчана кислота (d=1,84 г/см).
До пробірки з вивідною трубкою містять 3 краплі спирту, 2 краплі води та 3 краплі сірчаної кислоти. Охолодив розігріту спирто - кислотну суміш, в неї містять на кінці мікролопатки кілька кристалів броміду калію. Пробірку закріплюють під кутом у лапці штативу та обережно нагрівають вміст пробірки до кипіння. Кінець відвідної трубки занурюють у іншу пробірку, яка містить 6- 7 крапель води та охолоджують кригою. Нагрівання проводять до зникнення кристалів броміду калію у реакційній пробірці.
В приймачі утворюється 2 шари: нижній - бромистий етил, верхній - вода. За допомогою піпетки вилучають верхній шар. Скляною паличкою вносять 1 краплю бромистого етилу у полум'я пальника. Полум'я забарвлюється по краях у зелений колір.
Хімізм процесу:
C2H5OH + OH – SO3H «C2H5 – O – SO3H + HOH (етилсірчана кислота)
KBr + H2SO4 «HBr + KHSO4 (гідросульфат калію)
C2H5 – O – SO3H + HBr ® C2H5Br + H2SO4
бромистий етил
Найбільш зручним засобом одержання галогеналкілів є заміщення гідроксильної групи спиртів R - ОН на галоген. Одержання галогенпохідних зі спиртів використовується у великих масштабах, так як спирти - легко доступні та добре вивчені сполуки. У деяких випадках при отриманні галогеналкілів замість галогенводнів застосовують галогеніди фосфору.
Дослід 2. Одержання бромбензолу.
Реактиви та матеріали: бензол; бром; залізо (ошурки); натронне вапно; їдкий натр, 2 н розчин. (Дослід проводять у витяжній шафі).
До сухої пробірки містять трохи залізних ошурок, 5 крапель бензолу та 2 краплі брому. Отвір пробірки одразу зачиняють пробкою з газовідвідною трубкою, до якої прикріплена скляна трубка - поглинач з натронним вапном. Реакція починається негайно, суміш при цьому майже не розігрівається. Після того як в реакційній пробірці припиниться виділення бульбашок НВг та зникнуть забарвлені пари брому, її містять до водяної бані та нагрівають 2 хв. за температурою 60- 70'С. Отриманий бромбензол охолоджують та промивають від слідів брому розчином їдкого натру майже до знебарвлення. Верхній водний шар підбирають за допомогою піпетки. З бромбензолом проводять якісну реакцію на галоген.
Хімізм процесу:
2Fe + 3 Br2 ® 2FeBr3
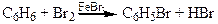
Дослід 3. Бромування стиролу.
Реактиви та матеріали: стирол, бром, оцтова кислота, крижана.
У витяжній шафі дуже обережно готують розчин брому у крижаній оцтовій кислоті.
До пробірки містять 3 краплі стиролу і при постійному змішуванні по 1 краплі додають розчин брому, доки чергова крапля брому не перестане знебарвлюватись. До одержаного розчину додають 5 крапель холодної води, через деякий час випадає білий осад фенілдиброметану.
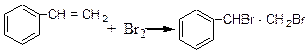
За цих умов відбувається приєднання брому за містом подвійного зв'язкуу боковому ланцюгу.
Дослід 4. Міцність галогену, який знаходиться у бензольному кільці.
Реактиви та матеріали: хлорбензол; нітрат срібла, 0,2 н розчин.
До пробірки містять 1 краплю хлорбензолу, 5 крапель води та нагрівають до кипіння. До гарячого розчину приливають 1 краплю розчину нітрату срібла. Виникнення білого осаду або муті хлориду срібла не спостерігається. Це підтверджує міцність зв'язку галогену з ядром. Атом галогену зв'язан з бензольним ядром. В наслідок утворюється часткова двозв'язаність - С- Hal, яка приводить до зменшення довжини зв’язку та зростанню її енергії. Сполучення зменшує полярність зв'язку С- Наl й тим самим ускладнює умови для протікання реакцій заміщення.
Рухомість галогену в ядрі збільшують електрон - акцепторні замісники. Наприклад нітрогрупа в пара - або орто - положенні до галогену.
Дослід 5. Легка рухомість галогену, який знаходиться у боковому ланцюгу.
Реактиви та матеріали: хлористий бензил; нітрат срібла, 0,2 н розчин.
У пробірку містять 1 краплю хлористого бензилу, 5 крапель води нагрівають до кипіння та додають 1 краплю розчина нітрату срібла. Негайно випадає осад білого кольору хлориду срібла.
Хімізм процесу:
C6H5 – CH2Cl + HOH ® C6H5 – CH2OH + HCl
хлористий бензил бензиловий спирт
HCl + AgNO3 ® AgCl + HNO3
Атом галогену a - вуглецевого атому бокового ланцюгу має велику рухомість.
ЛІТЕРАТУРА
Основна:
1. Гранберг И.И. Практические работы и семинарские занятия по органической химии. М.: Высшая школа. 1987.
2. Домбровський А.В. Органічна хімія. Навч. посіб. – К.: Вища школа. 1991.
3. Писаренко А.П., Хавин З.Я. Курс органической химии. Издание перер. и доп. Учеб. для студентов нехимических специальностей. М.: Высшая школа. 1975.
4. Степаненко Б.Н. Курс органической химии. Учебник для студентов мединститутов. – М.: Высшая школа. 1974.
5. Степаненко Б.Н. Курс органической химии. Ч. 1 Алифатические соединения. М.: Высшая школа. 1981.
6. Степаненко Б.Н. Курс органической химии. (в 2-х частях), ч. 2. Карбоциклические и гетероциклические соединения. Учеб. для вузов. 6-е перер. и доп. М.: Высшая школа. 1981.
7. Тейлор Г. Основы органической химии для студентов нехимических специальностей./ пер. с англ. Е.Д./ М.: Мир. 1989.
8. Грандберг И.И. Органическая химия. М.: Высшая школа. 1987.
9. Черных В.П., Зименковский Б.С., Гриценко И.С. Органическая химия. В 3-х томах. Харьков: Основа. 1993, 1995, 1998.
Додаткова література:
1. Васильева П.В. Практические работы по органической химии. Малый практикум. – М.: просвещение. 1987.
2. Гиттис С.С. Практикум по органической химии. Учебное пособие. М.: высшая школа. 1991.
3. Задачи и упражнения по органической химии. Учебное пособие для студентов хим.-био. Специальностей. М.: Просвещение. 1982.
4. Кост А.Н. Упражнения и задачи по органической химии. Учебное пособие. М.: Высшая школа. 1974.
5. Мановецький П.С. Органічна хімія. Лабораторний практикум. – К.:Вища школа. 1975.
6. Миронов В.А., Янковский С.А. Спектроскопия в органической химии. Сб. задач. Учебное пособие. М.: Химия. 1985.
7. Некрасов В.В. Руководство к малому практикуму по органической химии. – М.: Химия. 1975.
8. Янковская Л.А. Современные теоритические основы органической химии. – М.: Химия. 1978.
9. Бражко О.А. та ін. Методичні вказівки до лабораторних робіт з органічної хімії (для студентів біологічного факультету заочного відділення). Запоріжжя: ЗДУ. 1997.
10. Азотистые гетероциклы и алкалоиды. Под. ред. В.Г. Карцева, Г.А. Толстикова. Москва 2001.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 456; Нарушение авторских прав?; Мы поможем в написании вашей работы!