
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зависимость скорости реакции от рН 1 страница
|
|
|
|
На кожне питання 2-3 речення.
Питання
- Чим загрожує для суспільства прискорення соціально-політичної історії?
- Оцініть переваги і недоліки процесу глобалізації?
3. Як ви розумієте поняття деполяризації і поліцентризації?
4. У чому полягає криза інституту глобального лідерства?
5. До чого призведе переміщення центру світового розвитку з Заходу на Схід?
6. Чому глобальні міграційні потоки ідуть в протихід переміщенню центру світового економічного розвитку?
7. Як ви оцінюєте обмеження свободи заради забезпечення безпеки?
8. Чим загрожує віртуалізація суспільно-політичних відносин?
9. З якими трендами ви погоджуєтеся, з якими ні, і які тренди не згадав автор.
10. Вкажіть головну мету статті.
 На графике эта зависимость имеет вид колокола. На вершине кривой есть точка оптимума рН, где фермент имеет наибольшую активность. рН оказывает воздействие на степень ионизации кислотных и основных групп. При различных значениях рН активный центр может находиться в частично ионизированной или неионизированной форме, что оказывает влияние на третичную структуру активного центра и на формирование фермент-субстратного комплекса.
На графике эта зависимость имеет вид колокола. На вершине кривой есть точка оптимума рН, где фермент имеет наибольшую активность. рН оказывает воздействие на степень ионизации кислотных и основных групп. При различных значениях рН активный центр может находиться в частично ионизированной или неионизированной форме, что оказывает влияние на третичную структуру активного центра и на формирование фермент-субстратного комплекса.
Влияние рН.
Ферменты, как и все белки содержат много зараженных положительно и отрицательно групп (-NH2,-COOH), которые входят в состав аминокислот арг, лиз, асп, глу. Общий заряд зависит от соотношения между этими группами. Заряд белка-фермента изменяется в зависимости от концентрации в клетке ионов водорода, которые нейтрализуют (подавляют диссоциацию) карбоксильной группы:
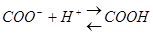
и образуют положительно заряженные группы: 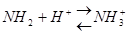
Таким образом увеличение положительного заряда или уменьшение отрицательного заряда на поверхности фермента обусловлено повышением концентрации ионов водорода.
Состояние белковой молекулы, при котором суммарный заряд белка равен 0, называется изоэлектрическим состоянием.
Значение рН, при котором заряд белковой молекулы равен 0, называется изоэлектрической точкой (ИЭТ).
Большинство ферментов отличаются наибольшей активностью и стабильностью в области изоэлектрической точки.
Резкие колебания рН способствуют денатурации белка, т.е. уменьшению ферментативной активности.
Значение рН, при котором фермент проявляет максимальную активность, называется оптимумом рН, который характерен для данного фермента, реагирующего с определенным субстратом.
Внутриклеточные ферменты обычно имеют оптимум рН соответствующий нейтральной среде (рН =7) близкой к нормальному значению рН для жидкостей организма. Есть ферменты оптимум рН которых находится в сильнокислой и сильнощелочной среде

Классификация ферментов.
Выделяют шесть классов ферментов:
1. Гидролазы – ферменты, расщепляющие субстрат при участии молекул воды.
2. Лиазы – ферменты, расщепляющие молекулы субстрата без участия воды, при этом часто образуются низкомолекулярные продукты – СО2, NH3, Н2О.
3. Изомеразы – ферменты, вызывающие в молекуле изомерные превращения.
4. Феразы (трансферазы) – ферменты, переносящие группы от одной молекулы на другую или из одного положения в другое в пределах одной молекулы.
5. Оксидоредуктазы - ферменты, катализирующие перенос протонов и электронов (т.е.окислительно-восстановительные реакции).
6. Лигазы(синтетазы) – ферменты, катализирующие синтез крупных молекул из более мелких.
Номенклатура ферментов.
Рабочее название фермента складывается из названия субстрата, типа катализируемой реакции и окончания –аза.
Систематическое название складывается из названия субстратов, названия типа катализируемого химического превращения и окончания –аза.

Название класса указывает на тип химической реакции, катализируемой ферментами. Классы делятся на подклассы – уточняет действие фермента, так как указывает на природу химической группы субстрата, атакуемой ферментом. Подкласс делится на подподклассы. Подподклассы конкретизируют действие фермента, уточняя природу атакуемой связи субстрата или природу акцептора.
I. Оксидоредуктазы катализируют окислительно-восстановительные реакции. Оксидоредуктазы называют также дегидрогеназами или редуктазами. Оксидоредуктазы переносят протоны и электроны. Оксидоредуктазы делят на подклассы:
1. Аэробные дегидрогеназы – переносят протоны и электроны на кислород.
Коферментами оксидоредуктаз являются:
НАД – никотинамидадениндинуклеотид – содержит витамин В5 – никотинамид.
НАДФ – никотинамидадениндинуклеотид фосфат, содержит витамин В5.
ФАД – флавинадениндинуклеотид, содержит витамин В2 – рибофлавин.
ФМН – флавинмононуклеотид, содержит витамин В2 – рибофлавин.
Оксидоредуктазы катализируют реакции дегидрирования, т.е. отщепление водорода.
Оксидоредуктазы окисляют следующие функциональные группы:
-ОН, -С=О, -NH2
|
Н
Коферменты дегидрогеназ присоединяют протоны и электроны.
НАД-зависимые дегидрогенизы окисляют следующие функциональные группы: спиртовый гидроксил (ОН), альдегидную группу (СОН), аминогруппу (NH2).
НАД-зависимые дегидрогеназы катализируют следующие типы реакций:
1. Дегидрирование гидроксильных групп
СН3 СООН
| лактатдегидрогеназа |

 HC-O С=О
HC-O С=О
| |
COOH НАД+ НАДН +Н+ СН3
Лактат пируват
Молочная кислота
2. Дегидрирование альдегидных групп (дегидрирование глицеральдегид – 3 – фосфата)
СН3 СООН
| + НАД+ + Н3РО4  | + НАДН + Н+
| + НАДН + Н+
HC-OH НC-OН
| |
CH2OPO3H2 CH2OPO3H2
Глицеральдегид-3-фосфат 1,3-бифосфоглицериновая кислота
3. Дегидрирование аминогрупп
СООН СООН
| |
СН2 +НАД СН2
 | | + НАДН + Н+
| | + НАДН + Н+
СН2 глутаматдегидрогеназа СН2
| |
СНNH2 С=О
| |
COOH СООН
Глутаминовая кислота 
ФАД – зависимые дегидрогеназы окисляют (дегидрируют) следующие функциональные группы: отщепление водорода от групп –СН2- СН2- с образованием двойной связи.
Пример:
СООН СООН
| ФАД ФАДН2 |
 СН2 СН
СН2 СН
 | ||
| ||
СН2 сукцинатдегидрогеназа СН
| |
СООН СООН
Сукцинат фумарат
2. Анаэробные дегидрогеназы переносят протоны и электроны не на кислород, а на какой-то другой субстрат. Эти ферменты называют также оксигеназами.
II. Трансферазы – ферменты, катализирующие реакции переноса различных групп от одного субстрата к другому.
Подклассы трансфераз:
1. Аминотрансферазы осуществляют перенос аминогруппы с аминокислоты на кетокислоту. Катализируют реакцию трансаминирования.
2. Метилтрансферазы катализируют перенос метильных групп (СН3-).
3. Фосфотрансферазы катализируют перенос остатка фосфорной кислоты. В подкласс фосфотрансфераз входят киназы, которые используют АТФ в качестве донора фосфатного остатка.
III. Лиазы – ферменты, катализирующие разрыв С-О, С-С, С-N и других связей, а также обратимые реакции отщепления различных групп, без участия воды.
1. Карбоксилазы – присоединение карбоксильной группы (СО2).
2. Дегидратазы – отнятие молекулы воды от субстрата.
3. Альдолазы – расщепляют связь С-С.
4. Гидратазы – ферменты воды по двойной связи.
IV. Изомеразы – ферменты, катализирующие превращение в пределах одной молекулы.
Катализируют реакции изомеризации. Подклассы: мутазы, таутомеразы, рацемазы, эпимеразы, изомеразы.
V. Гидралазы – ферменты, катализирующие разрыв связей в присутствии воды.
VI. Лигазы (синтетазы) – ферменты, катализирующие соединение двух молекул с использованием энергии фосфатной связи АТФ.
Влияние низкомолекулярных веществ на активность фенрментов.
Низкомолекулярные вещества, изменяющие скорость ферментативных реакций делят на 2 группы:
1. Активаторы – ускоряющие протекание ферментативной реакции.
2. Ингибиторы – замедляют протекание ферментативных реакций.
Активаторы делят на 2 группы:
1. В качестве активатора могут выступать коферменты или простетическая группа (в основном витамины).
Для этой группы характерны те же закономерности, что описаны для взаимодействия фермента и субстрата F+S и A+Ko подчиняются одним закономерностям 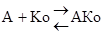

Km определяет сколько вводить Ko.
2. Активаторы, являющиеся связующим звеном между F и S (ориентирование фермента и субстрата) и обеспечивающим взаимодействие фермента и субстрата (F A S), взаимодействие апофермента и кофактора Апоф А Ко
Часто это ионы Ме – Со, Mn, Mg, Zn.
Значение ингибирования активности ферментов.
1. Ингибирование лежит в основе действия лекарственных веществ и токсических агентов.
2. Ингибирование – один из подходов к изучению ферментативного действия (например, структуры активного центра).
Ингибирование бывает 2-х видов:
1. Необратимое
2. Обратимое
Необратимое ингибирование имеет место тогда, когда присоединение ингибитора к ферменту носит необратимый характер.
 Например: это действие алкилирующих агентов (подацетамид) необратимо действующих на тиогруппу ферментов. Необратимость связана с тем, что равновесие смещено вправо, в сторону образования ковалентного производного фермента:
Например: это действие алкилирующих агентов (подацетамид) необратимо действующих на тиогруппу ферментов. Необратимость связана с тем, что равновесие смещено вправо, в сторону образования ковалентного производного фермента:
F-S-H + J-CH2CONH2  F-S-CH2-CONH2 + HJ
F-S-CH2-CONH2 + HJ
Необратимым является действие токстческих фосфоорганических соединений, которые называют нервно-паралитическими ядами, они ингибируют ацетилхолинэстеразу, участвующую в передаче нервных импульсов.
Необратимое ингибирование
Многие ингибиторы необратимо связываются с Е или ES, и, поскольку это влияет на Vmax, такое ингибирование относят к неконкурентному.
Ингибиторы этого типа часто ковалентно связываются с ферментом или с комплексом фермент-субстрат, необратимо изменяя нативную конфигурацию. Это объясняет токсическое действие Hg2+, Pb2+ и соединений мышьяка.
На необратимом ингибировании основано действие пенициллина. Пенициллин ингибирует действие одного из ферментов, участвующих в сборке клеточной стенки бактерий. Клетки, ен имеющие клеточной стенки, легко лизируются.
Действие аспирина основано на ковалентной модификации фермента. Аспирин снижает скорость синтеза простагландинов, выступая в роли ингибитора циклооксигеназного компонента эндопероксид-синтетазы. Считается, что возникновение болей, воспалений, температуры связано с простагландинами.
При интоксикации связывание яда или его вытеснение из комплекса фермент-ингибитор возможно с помощью реактиваторов, или противоядий. К ним относятся все SH – содержащие комплексоны (цистеин, димеркаптопропанол), лимонная кислота.
Обратимое ингибирование бывает 2-х видов:
1. Конкурентное
2. Неконкурентное
Обратимое конкурентное ингибирование – активность фермента восстанавливается после удаления ингибитора путем увеличения концентрации субстрата.
Отличительный признак конкурентного ингибитора – конкурентный ингибитор по структуре близок субстрату. Конкурентный ингибитор конкурирует с субстратом за активный центр фермента.
Пример: сукцинатдегидрогеназа катализирует превращение сукцината в фумарат. Конкурентным ингибитором сукцинатдегидрогеназы является малоновая кислота, которая содержит на одну группу СН2 меньше, чем сукцинат.
СООН СООН COOH
| СДГ | |
 СН2
СН2  СН CH2
СН CH2
 | || |
| || |
СН2 СН COOH
| | малоновая кислота
СООН СООН
Сукцинат и малоновая кислота являются структурными аналогами и конкурируют за активный центр фермента. (Это является подтверждением тому, что активный центр не является жестким образованием, подходящим субстрату, как «ключ-замок».)
При конкурентном ингибировании степень ингибирования фермента не зависит от абсолютной концентрации ингибитора, а от соотношения ингибитора и субстрата, если это соотношение J:S=1:50, то активность фермента ингибируется на 50%.
Действие конкурентного ингибитора снимается повышением концентрации субстрата, так как сродство фермента и субстрата выше, чем сродство фермента и ингибитора.
Кm F и S и Km F и J различны и это узнают путем построения графиков Михаэлиса-Ментен и Лайнуэвера-Бэрка


Vmax – одинакова
Km с ингибитором увеличивается.
Действие многих химиотерапевтических средств основано на конкурентном ингибировании. Например, сулфаниламидные препараты, используемые для лечения болезней, вызываемых микробными инфекциями. Сульфаниламидные препараты по структуре сходны с п-аминобензойной кислотой. ПАБК является предшественником в микробиологическом синтезе фолиевой кислоты, из которой кофермент, необходимый для синтеза нуклииновых кислот микроорганизмов. При введении сульфаниламидных препаратов наблюдается угнетение фермента и гибель микроорганизмов.
На конкурентном ингибировании основано применение и фторурацила, который используется при лечения рака.
Неконкурентное, обратимое ингибирование.
Действие неконкурентного ингибитора не может быть устранено увеличением концентрации субстрата.
Неконкурентный ингибитор не связывается с активным центром, он может связываться со свободным ферментом  , либо с комплексом FS
, либо с комплексом FS 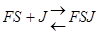 , либо с тем и другим, но обе формы JF и JFS – не активны.
, либо с тем и другим, но обе формы JF и JFS – не активны.


Km- не изменяется, т.к. нет связывания с активным центром.
Vmax – уменьшается.
Наиболее общий тип неконкурентного ингибирования имеет место при действии реагентов, обратимо связывающих SH-группы цис, входящего в каталитический центр или близко от него. Это ионы Cu2+, Hg2+, Ag+ и их производные с образованием меркаптидов:
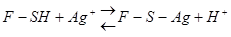
Ферменты, для активации которых необходимы ионы Ме ингибируются по такому способу агентами связывающими эти ионы:
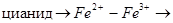 ферро или ферроцианид.
ферро или ферроцианид.
Регуляция активности ферментов.
Использование ферментов в фармации, медицине.
Виды регуляции активности ферментов:
1. Аллостерическая модификация.
2. Активация зимогенов.
3. Регуляция путем химической модификации.
Аллостерическая модификация.
 Этот вид активации характерен для ключевых обменных процессов:
Этот вид активации характерен для ключевых обменных процессов:
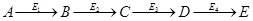
Ключевой фермент начинает (открывает) процесс.
Ферменты, от активности которых зависит скорость процесса, называются регуляторными или аллостерическими.
Особенности аллостерических ферментов.
1. Регуляторные ферменты – это олиго или мультиферменты.
2. Регуляторные ферменты имеют аллостерический центр или центры, которые формируются за счет 2 или нескольких протомеров.
3. Для регуляторных ферментов характерен сигмоидный характер зависимости скорости реакции от концентрации субстрата.
S-образная форма кривой объясняется по-видимому тем, что регуляторный фермент состоит не из одной полипептидной цепи, а из нескольких. Каждый протомер обладает свойством связывать субстрат (есть субстратные и каталитические центры на каждом протомере) с образованием F-S-комплекса. Активные центры конкурируют между собой за субстрат до тех пор пока не произойдет полного насыщения всех активных центров, после этого скорость реакции быстро достгает максимума.
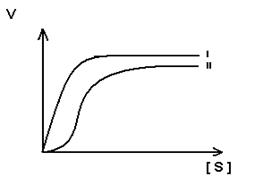 I.- простой фермент
I.- простой фермент
II – регуляторный фермент.
Вещества, связывающиеся с активны центром и изменяющие структуру белковой молекулы фермента, а следовательно и пространственную ориентацию функциональных групп аминокислот, составляющих субстратный и каталитический центры называют модификаторами.
Модификаторы бывают двух видов:
1. Положительные модификаторы (+) – после присоединения активность ферментов повышается.
2. Отрицательные модификаторы(-) после взаимодействия с ферментом снижают его активность.
Модификаторы обычно низкомолекулярные вещества. Это субстраты конечные продукты реакции.
Различают три вида регуляторных ферментов:
1. Гомотропные – для этого класса ферментов субстрат является положительным модулятором или регуляция по принципу прямой положительной связи.
2. Гетеротропные – активируются другими модификаторами, ингибируются конечным продуктом или регуляция по принципу обратной отрицательной связи.
3. Гомогетеротропные – для этих ферментов характерно смешанное регулирование и субстратом и другими соединениями.
Активация зимогенов.
Многие пищеварительные ферменты синтезируются в неактивной форме – в виде зимогенов (пепсиноген, трипсиноген и др.).
Эти неактивные зимогены активируются после попадания в ЖКТ, благодаря этому не происходит переваривания клеток, где происходит синтез ферментов. Зимогены не активны, так как содержат дополнительные участки или группы, которые препятствуют доступу субстрата к активному центру. Удаление этой блокирующей группы протеолитическими ферментами приводит к необратимой активации зимогена.
Трипсиноген 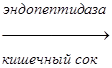
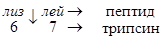
Эндопептидаза расщепляет пептидную связь между лиз в положении 6 и лей в положении 7, в результате отщепляется пептид и образуется активный трипсин.
Схема активации зимогена:
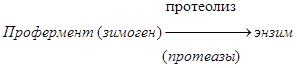
По такой схеме происходит активация целого ряда зимогенов:
1. Пищеварительные ферменты
2. Ферменты свертывания крови
3. Белковые гормоны
4. Кининовая система, компонент
5. Фибриллярный белок проколлоген  коллоген.
коллоген.
Основная черта активации зимогенов заключается в каскадном (последовательном) включении зимогенов с образованием активных ферментов например 12-перстной кишки.
Регуляция путем химической модификации.
По существу это изменение химической структуры активного центра. В некоторых случаях фермент может существовать в клетке в неактивной форме или слабоактивном состоянии, но присоединение фосфатной группы при участии фосфорилирующего фермента, называемого киназой, к аминокислоте вблизи от активного центра, активирует фермент. Такая система может быть возвращена в исходное состояние под действием фермента, отщепляющего фосфатную группу.
Киназа Ф
 F (актив)
F (актив)
 F(неакт) Ф
F(неакт) Ф
Фосфотаза – Ф
Такой механизм очень важен, т.к. активность киназы и фосфатазы могут изменяться под действием гормонов.
Уровни организации ферментов в клетке.
Большинство ферментов в клетке имеют сложное строение, т.е. это мультиферменты.
По сложности молекулярная организация мультиферменые системы, осуществляющие последовательные реакции можно разделить на 3 уровня.
I уровень организации
В простейших мультиферментных системах отдельные ферменты растворены в цитозоле и работают независимо друг от друга; предполагается, что во время своего действия они физически друг с другом не связаны. Небольшие молекулы субстрата, характеризующиеся высокой скоростью диффузии, очень быстро находят дорогу от одного фермента к другому:

II уровень организации
Отдельные ферменты, относящиеся к этим системам, могут ассоциировать друг с другом в форме ферментных комплексов.
Например: синтетаза жирных кислот, представляющая систему из семи разных ферментов, молекулы которых объединены в тесно связанный комплекс, который с трудом распадается на отдельные ферменты, причем после диссоциации все они оказываются неактивными (биологически выгодно – сокращается скорость образования конечного продукта).
III уровень организации
Это наиболее высокоорганизованные ферментные системы, связанные с крупными надмолекулярными структурами (мембраны, рибосомы).
Цепь дыхательных ферментов, прикрепленных к мембране митохондрий и представляющих собой по существу часть мембраны. Мембраны могут изменять специфичность ферментов, изменяя пространственную конформацию белковой молекулы фермента (четмертичная структура). Например, АТФ-аза, связанная с мембраной синтезирует АТФ, а свободная разрушает.
Биологическое окисление.
В процессе обмена веществ пищевые продукты (углеводы, липиды) подвергаются катаболизму.
Катаболизм – это процесс расщепления высокомолекулярных веществ до низкомолекулярных веществ, идущий с выделением энергии. В процессе катаболизма происходит упрощение структуры высокомолекулярных веществ.
Энергия, выделившаяся в процессе катаболизма, используется для синтеза новых веществ, т.е. в процессе анаболизма.
Взаимодействие превращения вещества и энергии называются метаболизмом.
Процессы окисления протекают в организме и вне организма. Эти процессы имеют сходства и различия.
Сходство между окислением в организме и вне организма.
1. В результате окисления образуются одинаковые конечные продукты СО2 и Н2О.
2. Выделяется одинаковое количество энергии.
Различия между окислением в организме и вне организма.
1. Вне организма энергия выделяется за счет окисления атомов углерода, а в организме за счет окисления атомов водорода.
2. Вне организма кислород соединяется с окисляемым субстратом. В организме кислород не соединяется с субстратом.
3. Вне организма энергия выделяется одномоментно и не аккумулируется, т.е. не запасается. В организме энергия выделяется порциями, «каскадно» и аккумулируется (запасается). «Каскадное» выделение энергии предохраняет клетку от перегрева.
4. Основной реакцией окисления в организме является реакция дегидрирования, т.е. отщепление водорода (протонов). Вспомогательными реакциями являются реакции дегидратации и декарбоксилирования.
5. Процесс окисления в организме многоступенчатый, ферментативный процесс.
Процесс окисления субстратов в биологических объектах называется биологическим окислением.
Виды биологического окисления.
1. Тканевое дыхание
2. Субстратное окисление
Тканевое дыхание – многоступенчатый ферментативный процесс, в котором конечным акцептором электронов является кислород.
В процессе тканевого дыхания участвую ферменты – оксидоредуктазы, образующие дыхательную цепь.
Дыхательная цепь – это комплекс оксидоредуктаз, участвующих в переносе протонов и электронов от окисляемого субстрата к кислороду.
Дыхательная цепь локализована в кристах митохондрий.
Строение дыхательной цепи.
Дыхательная цепь включает 4 группы ферментов:
1. Пиридинзависимые дегидрогеназы – коферментом является НАД, НАДФ.
2. Флавинзависимые дегидрогеназы – коферментом является ФАД, ФМН.
3. Коэнзим Q или убихинон.
4. Цитохромы b, c, a, a3.
Цитохромы являются геминовыми белками, в качестве небелковой части содержат гем. В составе гема содержатся атом железа, который может изменять степень окисления с +3 до +2, присоединяя или отдавая электрон.
В составе дыхательной цепи выделяют два участка:
1. Участок, включающий пиридинзависимые дегидрогеназы – коэнзим Q обеспечивает перенос протонов и электронов. На уровне коэнзима Q протоны уходят в среду митохондрий, т.к. цитохромы по своему строению способны переносить только электроны.
2. Участок цитохромов, обеспечивающий перенос только электронов.
Основное значение цитохромной системы перенос электронов от окисляемого субстрата на молекулярный кислород с образованием воды:

Схема переноса электронов и протонов по дыхательной цепи.
 По дыхательной цепи от окисляемого субстрата до кислорода передается 2 протона и два электрона.
По дыхательной цепи от окисляемого субстрата до кислорода передается 2 протона и два электрона.
Коферменты дыхательной цепи принимая протоны и электроны превращаются в восстановленную форму, а отдавая их снова превращается в окисленную форму.
Движущей силой, обеспечивающей перенос протонов и электронов от субстрата к кислороду, является разность редокс-потенциалов. В дыхательной цепи происходит нарастание редокс-потенциала (от –0,32 в до +0,81 в О2)
Для синтеза одной макроэргической связи АТФ требуется перепад редокс-потенциалов между участками дыхательной цепи примерно в 0,22 в на пару перенесенных электронов.
Длина дыхательной цепи (количество ферментов) может быть различна и зависит от природы окисляемого субстрата.
Для клетки важно, чтобы молекула кислорода, присоединив 4 электрона, полностью восстановилась до двух молекул воды. При неполном восстановлении кислорода в случае присоединения двух электронов образуется перекись водорода, а в случае присоединения одного электрона – супероксидный радикал 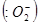 . Перекись водорода и супероксидный радикал токсичны для клетки, т.к. повреждают клеточные мембраны, взаимодействую с остатками ненасыщенных жирных кислот мембранных липидов.
. Перекись водорода и супероксидный радикал токсичны для клетки, т.к. повреждают клеточные мембраны, взаимодействую с остатками ненасыщенных жирных кислот мембранных липидов.
Аэробные клетки защищают себя от действия перекиси и супероксида с помощью двух ферментов: супероксиддисмутазы и каталазы.

Пути использования энергии переноса электронов.
При переносе пары электронов происходит изменение свободной энергии и эта энергия используется по двум путям:
1. Энергия переноса электронов используется на синтез АТФ.
2. Энергия переноса электронов используется для выработки тепла.
При переносе пары электронов по дыхательной цепи происходит изменение свободной энергии, равная 52,6 ккал. Этой энергии достаточно для синтеза 3 молекул АТФ. Синтез трех молекул АТФ в стандартных условиях требует затраты 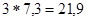 ккал.
ккал.
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 407; Нарушение авторских прав?; Мы поможем в написании вашей работы!