
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зависимость скорости реакции от рН 3 страница
|
|
|
|
Образование глюкозы из неуглеводных предшественников называется глюконеогенезом (образование нового сахара).
В процессе глюконеогенеза глюкоза синтезируется из лактата, пирувата, глицерола, и большинства аминокислот, из промежуточных продуктов цикла лимонной кислоты.
Глюконеогенез протекает в печени и значительно менее интенсивно – корковом веществе почек.
При гликолизе глю превращается в пируват, при глюконеогенезе пируват превращается в глюкозу. Глюконеогенез это не обращение гликолиза, т.к. в гликолизе есть 3 необратимые стадии, катализируемые гексокиназой, фосфофруктокиназой и пируваткиназой.
Пути глюконеогенеза обходят эти 3 необратимые реакции гликолиза при помощи следующих новых этапов:
1. Фосфоенолпируват ббразуется из пирувата через оксалоацетат.
Первый этап в обходной последовательности реакций катализируется митохондриальной пируваткарбоксилазой. Этот биотинзависимый фермент катализирует образование оксалоацетата из пирувата:
Пируват + СО2+АТФ 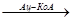 оксалоацетат+АДФ+Рн
оксалоацетат+АДФ+Рн
Пируваткарбоксилаза – регуляторный фермент; в отсутствии ацетил-КоА который служит для нее положительным регулятором, она почти полностью лишена активности.
Оксалоацетат, образующийся в митохондриях из пирувата обратомо восстанавливается за счет НАДН с образованием малата:
Митох. НАДН+Н+ + Оксалоацетат  НАД+малат
НАД+малат
Малат из митохондрий поступает в цитозоль. В цитозоле малат под действием цитозольной НАД-зависимой малатдегидрогеназы превращается в оксалоацетат:
Цитозоль Малат + НАД+  Оксалоацетат+ НАДН+Н+
Оксалоацетат+ НАДН+Н+
Дальше оксалоацетат под действием фосфоенолпируваткарбоксикиназы превращается в фосфоенолпируват:
Оксолоацетат+ГТФ  ФЭП+СО2 +ГДФ
ФЭП+СО2 +ГДФ
Донором фосфата в этой реакции служит ГТФ – гуанозинтрифосфат.
2. Вторая реакция гликолиза, которая не может использоваться для глюконеогенеза – это реакция фосфорилирования фру-6-ф, катализируемая фосфофруктокиназой.
В глюконеогенезе действует обходной путь с участием фруктозодифасфатазы, которая катализирует необратимый гидролиз фру-1,6-дф с образованием фру-6-ф
Фру-1,6-дф  фру-6-ф
фру-6-ф
Фруктозодифосфотаза – регуляторный фермент, нуждается в ионах Mg2+. Ингибируется АМФ, активируется АТФ.
3. Третьей обходной реакции в синтезе глюкозы является дефосфорилирование глю-6-ф с образованием глю.
Дефосфорилирование осуществляется под действием глюкозы-6-фосфатазы:
Глю-6-ф  глю
глю
Глюконеогенез требует значительных затрат энергии. Стадии глюконеогенеза, требующие затрат энергии:
Пир + СО2 + АТФ  оксалоацетат + АДФ + Фн
оксалоацетат + АДФ + Фн
Оксалоацетат + ГТФ  ФЕП + СО2 + ГДФ
ФЕП + СО2 + ГДФ
3ФГК  1,3ФГК
1,3ФГК
На каждую молекулу глю потребуется 6 высокоэнергетических фосфатных групп – 4 от АТФ и 2 от ГТФ.
Кроме того, для восстановительных этапов требуется 2 молекулы НАДН:
1,3 ДФГК + НАДН + Н+  3ФГА + НАД+
3ФГА + НАД+
Суммарная реакция:
2Пир + 4 АТФ + 2 ГТФ + 2 НАДН + 2 Н+ + 4 Н2О  Глю + 2 НАД+ + 4 АДФ + 2 ГДФ + 6 Рн
Глю + 2 НАД+ + 4 АДФ + 2 ГДФ + 6 Рн
Главную роль из метаболитов ЦТК, используемых в глюконеогенезе играют: цитрат, изоцитрат, 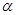 -кетоглутарат, сукцинат, фумарат, малат.
-кетоглутарат, сукцинат, фумарат, малат.
Важно отметить, что в норме ацетил-КоА не используется как предшественник глю, так как он не может превратиться в пируват.
В глюкозу могут превращаться глюкогенные аминокислоты: аланин, глутамат, аспартат, которые превращаются соответственно в пируват, оксалоацетат и 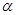 -кетоглутарат:
-кетоглутарат:
Глукогенные аминокислоты
Превращаются в пир: ала, сер, цис, гли
Превращаются в оксалоацетат: асп, асн
Превращаются в сукцинил-КоА: вал, тре, мет
Превращаются в 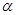 -кетоглутарат: глу, глн, про, арг, гис.
-кетоглутарат: глу, глн, про, арг, гис.
Поставляют атомы углерода для синтеза глю и кетоновых тел: фен,тир, изолей, лиз, три
Синтез глю из малых молекул предшественников идет в период после восстановления после мышечной нагрузки, например после бега на сто метров. В этом случая в качестве источника энергии служит гли, который окисляется с образованием лак и выделением АТФ. Т.к. кислорода в тканях не хватает, лактат не может подвергаться дальнейшим превращениям и поступает в кровь.
Закончивший стометровку спринтер в начале дышит тяжело, но постепенно его дыхание выравнивается и становится нормальным. К этому периоду возвращается к норме и содержание лак. За время восстановления (до 30 мин) лактат удаляется из крови в печень и превращается в процессе гликонеогенеза в глю крови. Глю крови возвращается в мышцы:

Алкоголь тормозит глюконеогенез.
Потребление больших количеств алкоголя резко тормозит глюконеогенез в печени, вследствие чего понижается содержание глю в крови, т.е. возникает гипогликемия. Это особенно сказывается после тяжелой физической нагрузки и на голодный желудок, уровень глю может понизиться до 40 и даже 30% от нормы. Гипергликемия не благоприятно сказывается на функции мозга. Она особенно опасна для тех областей мозга, которые контролируют температуру тела. Температура тела может понизиься на 20С. Старый обычай, предписывающий давать спасенным на море или в пустыне голодным или обессилившим людям водку, физиологически неоправдан и даже опасен; в таких случаях следует давать глю.
Окислительное декарбоксилирование пирувата.
Протекает в митохондриальном матриксе и связывает гликолиз с циклом трикарбоновых кислот.
Превращение пирувата в ацетил-КоА является необратимым процессом и катализируется пируватдегидрогеназным комплексом. Пируватдегидрогеназный комплекс состоит из трех ферментов и содержит пять коферментов: НАД, ФАД, ТПФ, амид липоевой кислоты, СоА. Этот процесс включает 4 реакции, суммарное уравнение записывается так:

Цикл трикарбоновых кислот.
Цикл начинается с конденсации оксалоацетата (ЩУК) с ацетил –КоА с образованием цитрата и КоА. Реакция катализируется цитратсинтетазой. Далее цитрат изомеризуется в изоцитрат, через стадию образования цис-аконитата. Изоцитрат под действием изоцитратдегидногеназы превращается в 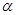 -кетоглуторат (2-оксоглутарат). Коферментом изоцитратдегидрогеназы является НАД. Дальше
-кетоглуторат (2-оксоглутарат). Коферментом изоцитратдегидрогеназы является НАД. Дальше 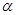 -кетоглутарат под действием
-кетоглутарат под действием 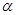 -кетоглутаратдегидрогеназного комплекса, содержащего НАД, ФАД, КоА, ТПФ и амид липоевой кислоты в качестве коферментов, превращается в сукцинил-КоА. На этом этапе происходит окислительное декарбоксилирование. В сукцинил-КоА имеется связь богатая энергией. При гидролизе сукцинил-КоА образуется около 8 ккал/моль, что сравнимо с величиной энергии, необходимой для синтеза АТФ (~7,3 ккал/моль).
-кетоглутаратдегидрогеназного комплекса, содержащего НАД, ФАД, КоА, ТПФ и амид липоевой кислоты в качестве коферментов, превращается в сукцинил-КоА. На этом этапе происходит окислительное декарбоксилирование. В сукцинил-КоА имеется связь богатая энергией. При гидролизе сукцинил-КоА образуется около 8 ккал/моль, что сравнимо с величиной энергии, необходимой для синтеза АТФ (~7,3 ккал/моль).
Расщепление тиоэфирной связи сукцинил-КоА сопряжено с фосфорилированием гуанозиндифосфата (ГДФ). Это реакция субстратного фосфорилирования, дающая 1моль АТФ. Это единственная реакция ЦТК, приводящая к образованию высокоэнергетической фосфатной связи. С циклом Кребса сопряжено окислительное фосфорилирование, где образование АТФ сопряжено с окислением НАД или ФАД под действием кислорода.
Затем сукцинат под действием сукцинатдегидрогеназы, содержащей ФАД в качестве кофермента превращается в фумарат. На следующей стадии фумарат подвергается реакции гидратации с образованием малата (яблочной кислоты). Малат под действием НАД-зависимой малатдегидрогеназы превращается в оксалоацетат. Следовательно, в цикле происходит регенерация оксалоацетата, что обеспечивает функционирование ЦТК.
3 НАДН и ФАДН2, образующиеся в цикле трикабоновых кислот, окисляются в дыхательной цепи (или в цепи переноса электронов). Генерирование АТФ происходит при транспорте электронов от этих переносчиков на О2. На каждую молекулу НАДН в митохондриях образуется 3 АТФ, а на молекулу ФАДН2 – 2 молекулы АТФ. Следовательно, в процессе окислительного фосфорилирования образуется 11 АТФ.
Молекулярный кислород непосредственно не участвует в цикле трикарбоновых кислот. Однако цикл функционирует лишь в аэробных условиях поскольку НАД+ и ФАД в митохондрии могут генерироваться только при переносе электронов на молекулярный кислород.
Значение ЦТК
1. * Цикл Кребса – основной путь расщепления обеспечивающий генерирование АТФ.
2. Амфиболическая – двойственная функция.
Катаболическая – распад ацетильных остатков
Анаболическая – субстраты цикла Кребса используются для синтеза.
3. Энергетическая функция – 1 АТФ
4. Водороддонорная функция – регенератор водорода для дыхательной цепи.
* Интегративная функция – объединение обмена углеводов, липидов и белков.


Патология обмена углеводов.
Нарушения обмена глюкозы проявляются в виде гипергликемии, глюкозурии и гипогликемии. Особую форму представляют нарушениями энергетического обмена при гипоксических состояниях.
Гипергликемия характеризуется повышением уровня глюкозы свыше 6 ммоль/л. Различают физиологические и патологические гипергликемии. К физиологическим гипергликемиям относятся алиментарные, возникающие при одномоментном приеме больших количеств углеводов, и нейтрогенные, например, при стрессовых ситуациях в результате выброса в кровь больших количеств адреналина. Физиологические гипергликемии носят транзиторный характер и быстро проходят.
Патологические гипергликемии обусловлены нарушением оптимального соотношения между секрецией гормонов гипо- и гипергликемического действия. Наиболее распространенное причина патологической гипергликемии – сахарный диабет, связанный с недостатком секреции инсулина поджелудочной железой. Кроме сахарного диабета гипергликемия сопутствует также заболеваниям гипофиза, сопровождающимся повышенной секрецией соматотропного гормона и АКТГ (акромегалия, опухоли гипофиза), опухолями мозгового слоя надпочечников, при которых усилено образование катехоламинов и коркового слоя надпочечников с усиленной продукцией глюкокортикоидов, гиперфункции щитовидной железы, некоторым болезням печени (инфекционный гепатит, цирроз печени).
Сахарный диабет – связан с недостаточностью инсулина, вырабатываемого  -клетками поджелудочной железы. Развитию сахарного диабета способствует избыточное потребление углеводов и жиров, малоподвижный образ жизни, стрессовые ситуации.
-клетками поджелудочной железы. Развитию сахарного диабета способствует избыточное потребление углеводов и жиров, малоподвижный образ жизни, стрессовые ситуации.
В основе сахарного диабета лежат следующие молекулярные дефекты:
1. Нарушение превращения проинсулина в инсулин в результате мутаций, затрагивающих аминокислотные остатки в участке соединения А-цепи (или В-цепи) с С-пептидом в проинсулине. У таких больных в крови высокое содержание проинсулина, лишенного гормональной активности.
2. Нарушение молекулярной структуры инсулина. Замена фен на лей сопровождается снижением гормональной активности в 10 раз.
3. Дефект рецепторов инсулина. У ряда больных секретируется нормальный инсулин, но нарушено его связывание с клетками-мишенями в результате дефекта рецепторов инсулина в плазматических мембранах.
4. Нарушение сопряжения рецепторов инсулина. У ряда больных секретируется нормальный инсулин, клетки-мишени содержат обычное количество рецепторов, но отсутствует сопряжение между инсулин-рецепторным комплексом и следующим компонентом в цепи передачи гормонального сигнала.
Важнейшими биохимическими признаками сахарного диабета являются:
1. Гипергликемия. В результате недостатка инсулина нарушается проникновение глюкозы в ткани и глюкоза накапливается в крови. В ответ на дефицит глюкозы в клетках печени усиливается распад гликогена и выход свободной глюкозы в кровь, что усугубляет гипергликемию. Возникает возможность развитие гипергликемической комы.
2. Глюкозурия и полиурия. Когда содержание глюкозы в крови превышает способность почечных канальцев к реабсорбции глюкозы она выделяется с мочой. Вместе с глюкозой выделяется много воды и больной испытывает голод и жажду.
3. Кетонемия и кетоурия. Вследствие дефицита глюкозы в тканях клетки начинают использовать в качестве энергии жиры. При  -окислении жирных кислот образуется Ацетил-КоА, который не сгорает с ЦТК полностью и из него синтезируются кетоновые тела: ацетоуксустная,
-окислении жирных кислот образуется Ацетил-КоА, который не сгорает с ЦТК полностью и из него синтезируются кетоновые тела: ацетоуксустная,  -оксимасляная кислоты и ацетон. Увеличение концентрации кетоновых тел в крови – кетонемия и выведение кетоновых тел с мочой – кетонурия.
-оксимасляная кислоты и ацетон. Увеличение концентрации кетоновых тел в крови – кетонемия и выведение кетоновых тел с мочой – кетонурия.
4. Нарушение кислотно-щелочного равновесия с развитием кетоацидоза.
Кетоновые тела сдвигают рН крови и тканевой жидкости в кислую сторону. Вначале буферные системы компенсируют сдвиг рН – компенсированный ацидоз. При тяжелых состояниях может возникнуть некомпенсированный ацидоз.
Методы диагностики сахарного диабета.
1. Определение глюкозы крови натощак.
2. Метод сахарной нагрузки (тест толерантности к глюкозе).
3. Диагностика неотложных состояний – определение глюкозы и ацетона в моче с помощью диагностических бумажных полосок – глюкотест и кетотест.
Метод сахарной нагрузки.
У больного берут кровь натощак, затем дают выпить сироп, содержащий 50г глюкозы в 200-250 мл воды. Далее через 30, 60, 150’ берут кровь и проводят определение глюкозы. У здорового человека (1) исходное содержание сахара в крови нормальное (< 5ммоль/л). После приема глюкозы в течении часа содержание глюкозы умеренно возрастает. В ответ на гипергликемию усиливается секреция инсулина, глюкоза переходит в ткани и ее содержание через 3 часа снижается до N и даже ниже.
У больного скрытым сахарным диабетом (2) содержание глюкозы на верхней границе нормы (5,7 ммоль/л). После нагрузки подъем сахара в крови более выражен и к 3 часу не достигает N из-за недостатка инсулина.
У больного явным сахарным диабетом (3) натощак определяется гипергликемия (9 ммоль/л). К 1 часу уровень глю достигает 15 ммоль/л и к 3 часу снижение незначительное, вследствие инсулинной недостаточности.
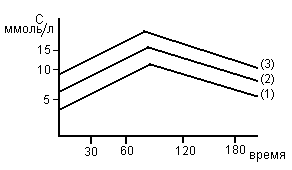
Клинические симптомы: повышенный аппетит, чувство жажды, которое сопровождается полиурией. Поздние симптомы: мышечная слабость, судороги при физических нагрузках, полиневриты – т.к. нарушается использование глюкозы нервными клетками.
Особенности обмена глюкозы в клетках опухали.
В клетках опухоли отмечается повышенная активность гексокиназы, что приводит к быстрому поглощению и окислению глюкозы. Опухолевая клетка является насосом, который выкачивает глюкозу из кровотока. В условиях быстро растущей опухоли система кровеносных сосудов отстает от роста опухоли и в таких клетках протекает анаэробный гликолиз, который и дает энергию для роста клеток. Выход энергии при анаэробном гликолизе составляет 2 моль АТФ и поэтому процесс должен идти с большой скоростью, чтобы обеспечить клетки опухоли энергией. Вследствие быстрого окисления глюкозы возникает гипогликемия. Возникновение гипогликемии вызывает ускорение глюконеогенеза и глюкоза начинает синтезироваться из аминокислот. Следствием синтеза глюкозы из аминокислот является падение веса у больных и развивается раковая кахексия.
1. Мембранная гексокиназа – работает как насос.
2. Гипогликемия.
3. Анаэробный гликолиз.
4. «Принудительный» глюконеогенез.
5. Раковая кахексия.
Гликогенозы.
Гликогенозы – наследственные заболевания, характеризующиеся избыточным отложением гликогена.
| Виды гликогенозов | |
| Печеночные | Мышечные |
| Смешанные |
Гликогеноз I типа (болезнь Гирке) характеризуется дефектом фермента глюкозо-6-фосфатазы.
Признаки гликогеноза: низкий уровень глюкозы натощак в крови, в тяжелых случаях судороги, замедление роста в результате подавления выработки инсулина. Накопление гликогена из-за большого количества глюкозо-6-фосфата и активации гликогенсинтетазы. Увеличение печени, гибель гепатоцитов, низкий рост, ацидоз (лактат, пирват).
Гликогеноз VI типа (болезнь Херса).
Дефект фосфорилазы. Накопление гликогена, характерны симптомы I типа, но менее выражены (глюкоза в кровь поступает).
Мышечные гликогенозы
Гликогеноз V типа – дефект или отсутствие фосфорилазы в мышцах. Мышечные судороги при физической нагрузке, мышечноя слабость, отсутствие гипогликемии. Синтез АТФ увеличивается за счет окисления жирных кислот.
Гликогеноз VII типа – дефект только фосфофруктосинтетазы. Переносят только умеренные физические нагрузки. Развивается гемолитическая анемия.
Гликогеноз III типа (болезнь Кори) – дефект или отсутствие гликоген-6-глбконогидролазы. Увеличение содержания гликогена в печени. Гликоген состоит из коротких цепей.
Гликогеноз IV (болезнь Андерсона) – недостаток «ветвящего» фермента. Накопление гликогена с аномально длинными цепями. Развивается цирроз печени.
Агликогеноз – дефект гликогенсинтетазы. Отсутствие гликогена или его очень мало, судороги, гипогликемия.
Гемолитические анемии.
Гликолиз в эритроцитах и транспорт кислорода связаны участием в обеих процессах 2,3-дифосфоглицерата. 2,3-дифосфоглицерат снижает сродство гемоглобина к кислороду и облегчает освобождение О2 в тканях.
1. При дефекте гексокиназы снижается концентрация промежуточных продуктов гликолиза, в том числе снижается концентрация 2,3-дифосфоглицерата. В таких эритроцитах гемоглобин обладает очень высоким сродством с О2. Наступает гемолиз эритроцитов, когда гемоглобин плохо обдает О2.
2. При дефекте пируваткиназы нарушается энергетический обмен и мембрана не получает энергию, необходимую для ионного обмена и наряду с этим образуется избыток 2,3-дифосфоглицерата и связь с О2 становится слабой, сродство гемоглобина к О2 становится низким.
Глю  Глю-6-ф
Глю-6-ф  Фру-6-ф
Фру-6-ф  Фру-1,6-дф
Фру-1,6-дф  3ФГА
3ФГА 

 1,3-ДФГК
1,3-ДФГК  3-ФГК
3-ФГК  2-ФГК
2-ФГК  ФЭП
ФЭП  Пир
Пир  Лак
Лак
2,3-ДФГК
2,3-ДФГК снижает сродство Hb к О2
Недостаточность глюкозо-6-фосфотдегидрогеназы – причина лекарственной гемолитической анемии.
У ряда больных малярией применение противомалярийного препарата памахина сопровождается гемолитической анемией. Через 30 лет после начала применения препарата была выяснена причина анемии. Было установлено, что возникновение анемии связано с недостаточностью глюкозо-6-фосфатдегидрогеназы в эритроцитах. В результате недостаточности фермента нарушается образование НАДФН в пентозофосфатном пути. Главная роль НАДФН в эритроцитах состоит в восстановлении дисульфидной формы глутатиона в сульфгидрильную форму.
Г-S-S-Г + НАДФН + Н+  Г-SH +НАДФ+
Г-SH +НАДФ+
Восстановленная форма глутатиона обеспечивает обезвреживание перекиси и органических перекисей:
2 Г-SH + R-O-OH  Г-S-S-Г + Н2О + ROH
Г-S-S-Г + Н2О + ROH
Клетки со сниженным содержанием восстановленного глутатиона обладают повышенной чувствительностью к гемолизу. Возможно, что в отсутствие восстановленного глутатиона памахин и ряд других лекарственных препаратов, вызывают изменения поверхности мембраны эритроцитов за счет образования токсических перекисей.
Недостаточность глюкозо-6-фосфатдегидрогеназы в эритроцитах, по-видимому, обуславливает устойчивость к тропической малярии, т.к. для роста возбудителя необходим нормально функционирующий пентозный путь и восстановленный глутатион. Дефект фермента распространен в тех странах, где распространена малярия. Такая наследуемая недостаточность фермента может быть относительно безвредной, до тех пор, пока не вводятся определенные лекарства.
Особенности обмена углеводов в различных органах и тканях.
1. Обмен углеводов в печени.
Одной из важнейших функций печени в процессах обмена веществ является ее участие в поддержании постоянного уровня глюкозы в крови (глюкостатическая функция): глюкоза, поступающая в избытке, превращается в резервную форму, которая используется в период, когда пища поступает в ограниченном количестве.
Энергетические потребности самой печени, как и других тканей организма, удовлетворяется за счет внутриклеточного катаболизма поступающей глюкозы. В печени катаболизм глюкозы представлен 2 процессами: 1) гликолитический путь превращения 1 моль глюкозы в 2 моль лактата с образованием 2 моль АТФ и 2) фосфоглюконатный путь превращения 1 моль глюкозы в 6 моль СО2 с образованием 12 моль НАДФ.Н. Оба процесса протекают в анаэробных условиях, обе ферментативные системы содержатся в растворимой части цитоплазмы, оба пути требуют предварительного фосфорилирования глюкозы.
Гликолиз обеспечивает энергией клеточные реакции фосфорилирования, синтез белка; пентозофосфатный путь служит источником энергии восстановления для синтеза жирных кислот, стероидов.
При аэробных условиях происходит сочетание гликолиза, протекающего в цитоплазме и цикла лимонной кислоты с окислительным фосфорилированием в митохондриях достигается максимальноый выход энергии в 38 АТФ на 1 моль глюкозы. Фосфотриозы, образующиеся в процессе гликолиза, могут быть использованы для синтеза  -глицерофосфата, необходимого для синтеза жиров. Пируват, который образуется при гликолизе, может быть использован для синтеза аланина, аспартата и других соединений, через стадию образования оксалоацетата. В печени реакции гликолиза могут протекать в обратном направлении и тогда происходит синтез глюкозы путем глюконеогенеза. В пентозофосфотном пути образуются пентозы, необходимые для синтеза НК. В отличие от гликолиза фосфоглюконатный путь необратим и здесь окисляется 1/3 глюкозы, 2/3 глюкозы окисляются по гликолитическому пути.
-глицерофосфата, необходимого для синтеза жиров. Пируват, который образуется при гликолизе, может быть использован для синтеза аланина, аспартата и других соединений, через стадию образования оксалоацетата. В печени реакции гликолиза могут протекать в обратном направлении и тогда происходит синтез глюкозы путем глюконеогенеза. В пентозофосфотном пути образуются пентозы, необходимые для синтеза НК. В отличие от гликолиза фосфоглюконатный путь необратим и здесь окисляется 1/3 глюкозы, 2/3 глюкозы окисляются по гликолитическому пути.
В печени протекают гликогенез и гликогенолиз. Эти процессы взаимосвязаны и регулируются как внутри – так и внеклеточными соотношениями между поступлением и потреблением глюкозы.


Роль печени в обмене углеводов.
От ЖКТ

Обмен углеводов в мышцах.
Печень учитывает запросы других органов и тканей в отношении углеводного обмена. В мышцах углеводный обмен происходит в соответствии с принципом самообслуживания.
Цель мышечной клетки – наиболее эффективно использовать поступающую глюкозу для образования АТФ, необходимого для осуществления механической работы – сокращения. В состоянии покоя значительные количества глюкозы резервируются в форме гликогена. Цитоплазма мышечных клеток содержит в высоких концентрациях ферменты гликолиза, а изобилие митохондрий обеспечивает эффективный распад продуктов гликолиза через путь лимонной кислоты и цепь переноса электронов. Лишь в условиях крайнего утомления эти аэробные процессы е справляются с накоплением лактата.
В мышцах идет гликогенез, мышца осуществляет лишь немногие синтетические функции. Ключевые ферменты глюконеогенеза в мышцах отсутствуют, и глюконеогенез не идет. Для востановительных синтезов в мышце НАДФ.Н не требуется, и фосфоглюконатный путь почти не функционирует.
Обмен углеводов в мышцах обеспечивает создание тканевых запасов гликогена в состоянии покоя и использование этих запасов, а также поступающей глюкозы при напряженной работе; основные энергетические потребности всех типов мышц удовлетворяются главным образом за счет окисления продуктов обмена жиров. Ни медленно сокращающаяся гладкая мышечная ткань, ни сердечная мышца не потребляют глюкозу в значительной мере. Во время напряженной работы сердце обеспечивает себя лактатом для окисления.
Обмен углеводов в мышце.


Фосфорилирование глюкозы в мышцах происходит под дейстием гексокиназы, в печени этот процесс катализируется глюкокиназой. Эти ферменты отличаются по Кm. Кm гексокиназы значительно ниже Кm глюкокиназы. Фермент мышц – гексокиназа участвует во внутриклеточной регуляции, т.е. этот фермент будет фосфорилировать глюкозу только до тех пор, пока глюкозо-6-ф используется в мышцах для гликолиза или образования гликогена.
Другое важнейшее различие между тканью печени и мышцы состоит в отсутствии в мышцах фермента глюкозо-6-фасфатазы.
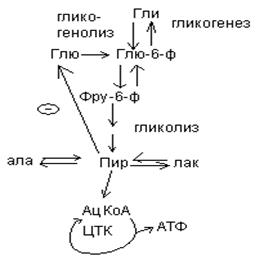
Обмен углеводов в мозге.
По сравнению со всеми органами тела функций мозга в наибольшей степени зависит от обмена углеводов. Если в крови, поступающей к мозгу, концентрация глюкозы становится вдвое ниже нормальной, то в течение нескольких секунд наступает потеря сознания, а через несколько минут – смерть. Для того чтобы обеспечить освобождение достаточного количества энергии, катаболизм глюкозы должен осуществляться в соответствии с аэробными механизмами; об этом свидетельствует даже более высокая чувствительность мозга к гипоксии, чем гипогликемии. Метаболизм глюкозы в мозге обеспечивает синтез нейромедиаторов, аминокислот, липидов, компонентов нуклеиновых кислот. Фосфоглюконатный путь функционирует в небольшой мере, обеспечивая НАДФ.Н для некоторых из этих синтезов. Основной катаболизм глюкозы в ткани мозга протекает по гликолитическому пути.
Гексокиназа мозга имеет высокое сродство к глюкозе, что обеспечивает эффективное использование глюкозы мозгом. Активность ферментов гликолиза велика.
Высокая активность митохондриальных ферментов цикла лимонной кислоты предотвращает накопление лактата в тканях мозга; большая часть пирувата окисляется до Ац-КоА. Небольшая часть Ац-КоА используется для образования нейромедиатора ацетилхолина. Основное количество Ац-КоА подвергается окислению в цикле лимонной кислоты и дает энергию. Метаболизм цикла Кребса используется для синтеза аспартата и глутамата. Эти аминокислоты обеспечивают обезвреживание аммиака в тканях мозга.
Мозг содержит мало гликогена (0,1% от общего веса); этот запас расходуется очень быстро.
Обмен углеводов в ткани мозга.

в условиях длительного голодания мозг использует как источник энергии кетоновые тела. В крайних случаях такие аминокислоты как глутамат и аспартат превращаются в соответствующие кетокислоты, которые способны к окислению с образованием энергии.
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 1206; Нарушение авторских прав?; Мы поможем в написании вашей работы!