
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Перелік питань 1 страница
|
|
|
|
з дисципліни «Методи вимірювання параметрів навколишнього природного середовища»
1. Визначити мідь і цинк у природній воді атомно-абсорбційним методом.
Завдання
1) Перелічити основні реагенти і апаратуру для визначення міді і цинку у природній воді.
1.Стандартний розчин сульфату міді, який містить 250 мкг/мл міді.
2. Стандартний розчин хлориду цинку, який містить 100 мкг/мл цинку.
3. Полум`яний атомно-абсорбційний спектрометр.
4. Лампи з полим катодом для визначення міді та цинку.
2) Виконати хід роботи для визначення хімічних елементів у природній воді.
Використовуючи стандартні розчини, які містять елементи - мідь і цинк, готують зразки порівняння, котрі містять: міді - 20, 40, 80 і 100 мкг/мл і цинку – 1, 2, 4 і 8 мкг/мл. Для цього в чотири мірні колби місткістю 25 мл вводять розраховані об'єми стандартних розчинів міді і цинку, розбавляють вміст колб до мітки дистильованою водою і ретельно перемішують. У мірній колбі місткістю 25 мл отримують аналізуємий зразок води - природну воду. Включають прилад, встановлюють лампу з полим катодом одного з елементів, наприклад, для визначення міді, і необхідні для роботи параметри: струм живлення лампи, напруга фотопримножувача, коефіцієнт посилення фотоструму, довжину хвилі резонансної лінії міді.
Зразки порівняння фотометрують послідовно у порядку збільшення концентрації даного елементу — міді.
Після промивання розпилювача і пальника дистильованою водою вводять у полум'я аналізуємий зразок води і вимірюють, величину атомного поглинання при тих же параметрах роботи атомно-асорбційного спектрофотометру. При фотометруванні зразків порівняння вимірюють не менш 6-10 величин оптичної щільності, а для побудови розподілу результатів вимірювання - не менш ~ 30-40 величин.
Будують градуювальник графік залежності величини оптичної щільності. А від концентрації міді (мкг/мл) по графіку визначають концентрацію міді в аналізуємій пробі води.
Встановлюють лампу з полим катодом для визначення цинку і необхідні параметри приладу. Промивають пальник і розпилюючу систему дистильованою водою. Далі визначають концентрацію цинку в аналізуємій пробі води (як описано вище для визначення міді).
Результати визначення міді і цинку обробляють статистично. Результати хімічного аналізу часто мають розподіл, близький до нормального (гауссового). Щоб у цьому упевнитися, вимірюють 30-40 значень оптичної щільності аналізуємого розчину, розраховують з них відповідні величини концентрацій і складають таблицю частот отриманих значень. Для цього весь діапазон отриманих значень розбивають на 5-6 областей по можливості рівного розміру так, щоб в кожній області було не менш 3-5 значень, і підраховують абсолютні (n j) і відносні (рі = nj/n, де n - загальне число даних) числа значень, які потрапили у і-у область. По отриманим даним будують експериментальну функцію розподілу результатів у виді гістограми.
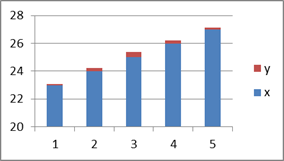
3) Побудувати гістограму розподілу результатів атомно-абсорбційного аналізу, відкладаючи по осі Х границі області, а по осі У – відносне число результатів. Розподіл експериментальних даних показано в таблиці 1.
Таблиця 1. – Експериментальні дані для побудови гістограми
розподілу результатів.
| Номер області j | Границі області, мкг/мл | Число результатів | |
| Абсолютне (nj) | Відносне (pj) | ||
| 23-24 | 0,06 | ||
| 24-25 | 0,23 | ||
| 25-26 | 0,40 | ||
| 26-27 | 0,20 | ||
| 27-28 | 0,11 |
2. Визначити мідь і цинк у природній воді атомно-абсорбційним методом.
Завдання
1) Перелічити основні реагенти і апаратуру для визначення міді і цинку у природній воді.
1.Стандартний розчин сульфату міді, який містить 250 мкг/мл міді.
2. Стандартний розчин хлориду цинку, який містить 100 мкг/мл цинку.
3. Полум`яний атомно-абсорбційний спектрометр.
4. Лампи з полим катодом для визначення міді та цинку.
2) Виконати хід роботи для визначення хімічних елементів у природній воді.
Використовуючи стандартні розчини, які містять елементи - мідь і цинк, готують зразки порівняння, котрі містять: міді - 20, 40, 80 і 100 мкг/мл і цинку – 1, 2, 4 і 8 мкг/мл. Для цього в чотири мірні колби місткістю 25 мл вводять розраховані об'єми стандартних розчинів міді і цинку, розбавляють вміст колб до мітки дистильованою водою і ретельно перемішують. У мірній колбі місткістю 25 мл отримують аналізуємий зразок води - природну воду. Включають прилад, встановлюють лампу з полим катодом одного з елементів, наприклад, для визначення міді, і необхідні для роботи параметри: струм живлення лампи, напруга фотопримножувача, коефіцієнт посилення фотоструму, довжину хвилі резонансної лінії міді.
Зразки порівняння фотометрують послідовно у порядку збільшення концентрації даного елементу — міді.
Після промивання розпилювача і пальника дистильованою водою вводять у полум'я аналізуємий зразок води і вимірюють, величину атомного поглинання при тих же параметрах роботи атомно-асорбційного спектрофотометру. При фотометруванні зразків порівняння вимірюють не менш 6-10 величин оптичної щільності, а для побудови розподілу результатів вимірювання - не менш ~ 30-40 величин.
Будують градуювальник графік залежності величини оптичної щільності. А від концентрації міді (мкг/мл) по графіку визначають концентрацію міді в аналізуємій пробі води.
Встановлюють лампу з полим катодом для визначення цинку і необхідні параметри приладу. Промивають пальник і розпилюючу систему дистильованою водою. Далі визначають концентрацію цинку в аналізуємій пробі води (як описано вище для визначення міді).
Результати визначення міді і цинку обробляють статистично. Результати хімічного аналізу часто мають розподіл, близький до нормального (гауссового). Щоб у цьому упевнитися, вимірюють 30-40 значень оптичної щільності аналізуємого розчину, розраховують з них відповідні величини концентрацій і складають таблицю частот отриманих значень. Для цього весь діапазон отриманих значень розбивають на 5-6 областей по можливості рівного розміру так, щоб в кожній області було не менш 3-5 значень, і підраховують абсолютні (n j) і відносні (рі = nj/n, де n - загальне число даних) числа значень, які потрапили у і-у область. По отриманим даним будують експериментальну функцію розподілу результатів у виді гістограми.
3) Побудувати гістограму розподілу результатів атомно-абсорбційного аналізу, відкладаючи по осі Х границі області, а по осі У – відносне число результатів. Розподіл експериментальних даних показано в таблиці 1.
Таблиця 1. – Експериментальні дані для побудови гістограми
розподілу результатів.
| Номер області j | Границі області, мкг/мл | Число результатів | |
| Абсолютне (nj) | Відносне (pj) | ||
| 17-18 | 0,07 | ||
| 18-19 | 0,11 | ||
| 19-20 | 0,30 | ||
| 20-21 | 0,50 | ||
| 21-22 | 0,25 |

3. Визначити мідь і цинк у природній воді атомно-абсорбційним методом.
Завдання
1)Перелічити основні реагенти і апаратуру для визначення міді і цинку у природній воді.
1.Стандартний розчин сульфату міді, який містить 250 мкг/мл міді.
2. Стандартний розчин хлориду цинку, який містить 100 мкг/мл цинку.
3. Полум`яний атомно-абсорбційний спектрометр.
4. Лампи з полим катодом для визначення міді та цинку.
2) Виконати хід роботи для визначення хімічних елементів у природній воді.
Використовуючи стандартні розчини, які містять елементи - мідь і цинк, готують зразки порівняння, котрі містять: міді - 20, 40, 80 і 100 мкг/мл і цинку – 1, 2, 4 і 8 мкг/мл. Для цього в чотири мірні колби місткістю 25 мл вводять розраховані об'єми стандартних розчинів міді і цинку, розбавляють вміст колб до мітки дистильованою водою і ретельно перемішують. У мірній колбі місткістю 25 мл отримують аналізуємий зразок води - природну воду. Включають прилад, встановлюють лампу з полим катодом одного з елементів, наприклад, для визначення міді, і необхідні для роботи параметри: струм живлення лампи, напруга фотопримножувача, коефіцієнт посилення фотоструму, довжину хвилі резонансної лінії міді.
Зразки порівняння фотометрують послідовно у порядку збільшення концентрації даного елементу — міді.
Після промивання розпилювача і пальника дистильованою водою вводять у полум'я аналізуємий зразок води і вимірюють, величину атомного поглинання при тих же параметрах роботи атомно-асорбційного спектрофотометру. При фотометруванні зразків порівняння вимірюють не менш 6-10 величин оптичної щільності, а для побудови розподілу результатів вимірювання - не менш ~ 30-40 величин.
Будують градуювальник графік залежності величини оптичної щільності. А від концентрації міді (мкг/мл) по графіку визначають концентрацію міді в аналізуємій пробі води.
Встановлюють лампу з полим катодом для визначення цинку і необхідні параметри приладу. Промивають пальник і розпилюючу систему дистильованою водою. Далі визначають концентрацію цинку в аналізуємій пробі води (як описано вище для визначення міді).
Результати визначення міді і цинку обробляють статистично. Результати хімічного аналізу часто мають розподіл, близький до нормального (гауссового). Щоб у цьому упевнитися, вимірюють 30-40 значень оптичної щільності аналізуємого розчину, розраховують з них відповідні величини концентрацій і складають таблицю частот отриманих значень. Для цього весь діапазон отриманих значень розбивають на 5-6 областей по можливості рівного розміру так, щоб в кожній області було не менш 3-5 значень, і підраховують абсолютні (n j) і відносні (рі = nj/n, де n - загальне число даних) числа значень, які потрапили у і-у область. По отриманим даним будують експериментальну функцію розподілу результатів у виді гістограми.
3) Побудувати гістограму розподілу результатів атомно-абсорбційного аналізу, відкладаючи по осі Х границі області, а по осі У – відносне число результатів. Розподіл експериментальних даних показано в таблиці 1.
Таблиця 1. – Експериментальні дані для побудови гістограми
розподілу результатів.
| Номер області j | Границі області, мкг/мл | Число результатів | |
| Абсолютне (nj) | Відносне (pj) | ||
| 25-26 | 0,09 | ||
| 26-27 | 0,13 | ||
| 27-28 | 0,20 | ||
| 28-29 | |||
| 29-30 | 0,23 |

4. Визначити концентрацію заліза в питній воді.
Завдання
1.) Перелічити основні реактиви та посуд для визначення вмісту заліза в питній воді.
1. Стандартний (основний) розчин залізоамонійних квасців, вміщаючих 0,1 мг Fе в 1 см3 розчину.
2. Стандартний (робочий) розчин залізоамонійних квасців, вміщаючих 0,01 мг Fе в 1см3 розчину.
3. Роданід калію чи амонію, 50%-ний розчин.
4. Персульфат амонію чи калію в кристалах.
5. Соляна кислота (1:1), вільна від заліза.
6. Колби мірні місткістю 50 см3 (8 штук).
7. Колби конусні місткістю 100 см3 (2 шт.).
8. Чашки фарфорові на 100 см3 (2 шт.).
9. Лійки (2 шт.).
10. Шпатель.
11. Папір фільтрувальний.
12. Кислота сірчана концентрована.
13. Фотоколориметр КФК - 2МП.
14. Електрична плитка. Сушильна шафа.
15.Терези ВЛР-200г.
16.Витяжна шафа.
2.) Описати методику приготування основного та робочого розчинів.
Підготовчі роботи. Приготування реактивів
1.)Приготування стандартного (основного) розчину залізоамонійних квасців.
Беруть наважку Fe(NH4) (SO4)2 *12Н20 0,8634 г, розчиняють в невеликій кількості дистильованої води, додають 10 см3 концентрованої сірчаної кислоти питома вага 1,84, доводять об'єм до 1 дм3. 1 см розчину містить 0,1 мг заліза.
2.)Приготування стандартного (робочого) розчину
Основний розчин розбавляють в 10 раз дистильованою водою (готують в день виконання аналізу). Для цього 10 см3 основного стандартного розчину, взятого мірною піпеткою на 10 см3 переносять в мірну колбу на 100 см3 і доводять об'єм до мітки дистильованою водою. Розчин ретельно перемішують. 1 см3 розчину містить 0,01 мг заліза.
Побудова колібрувального графік.
В мірні колби на 50 см відміряють: 0; 0,5; 1; 2; 3; 4 та 5 см3 робочого стандартного розчину залізо амонійних квасців і доводять об'єм до мітки дистильованою водою.
Вміст заліза в серії стандартних розчинів складає: 0-0,1-0,2-0,4-0,6-0,8-1 мг/дм3.
До стандартних розчинів і контрольної проби додають по 1 см3 розчину соляної кислоти (1:1) і декілька кристаликів персульфату амонію, розчин перемішують.
Після перемішування в колби вводять по 1см3 50%-го розчину роданіду калію, знову перемішують, визначають оптичну щільність розчинів, після чого будують колібровочний графік залежності оптичної щільності від концентрації заліза в міліграмах на дециметр кубічний (із знайдених значень розраховують оптичну щільність контрольної проби, якщо користуються колориметром старого зразку).
При вимірюванні інтенсивності кольору користуються синьо-зеленим світлофільтром (X = 500 нм), товща шару робочого розчину 2-5 см.
Аналітичний контроль зразку води
В мірну колбу на 50 чи 100 см3 (завдає викладач) наливають до мітки досліджувану воду, додають 1см3 соляної кислоти (1:1), декілька кристаликів персульфату амонію, перемішують, потім додають 50%-ний розчин роданіду калію. Після перемішування вимірюють оптичну щільність і по колібровочному графіку знаходять відповідну їй величину кількості заліза.
Вміст заліза:
ХРе = С*50/V,
де,
С - концентрація заліза, знайдено по колібровочному графіку;
V - об'єм проби, взятої для визначення, см3.
При звичайних умовах це 50 або 100 см3. При других умовах об'єм проби може бути зменшеним або збільшеним.
3) Розрахувати вміст заліза в питній воді за вихідними даними:
- концентрація заліза, знайденого за калібрувальним графіком дорівнює
0,6 мг/дм3;
- об’єм проби, взятої для визначення дорівнює 50 см3.
ХРе = 0,6*50/50=0,6 (мг/см3)
5. Визначити концентрацію заліза в питній воді.
Завдання
1) Перелічити основні реактиви та посуд для визначення вмісту заліза в питній воді.
1. Стандартний (основний) розчин залізоамонійних квасців, вміщаючих 0,1 мг Fе в 1 см3 розчину.
2. Стандартний (робочий) розчин залізоамонійних квасців, вміщаючих 0,01 мг Fе в 1см3 розчину.
3. Роданід калію чи амонію, 50%-ний розчин.
4. Персульфат амонію чи калію в кристалах.
5. Соляна кислота (1:1), вільна від заліза.
6. Колби мірні місткістю 50 см3 (8 штук).
7. Колби конусні місткістю 100 см3 (2 шт.).
8. Чашки фарфорові на 100 см3 (2 шт.).
9. Лійки (2 шт.).
10. Шпатель.
11. Папір фільтрувальний.
12. Кислота сірчана концентрована.
13. Фотоколориметр КФК - 2МП.
14. Електрична плитка. Сушильна шафа.
15.Терези ВЛР-200г.
16.Витяжна шафа.
2) Описати методику приготування основного та робочого розчинів.
Підготовчі роботи. Приготування реактивів
1.)Приготування стандартного (основного) розчину залізоамонійних квасців.
Беруть наважку Fe(NH4) (SO4)2 *12Н20 0,8634 г, розчиняють в невеликій кількості дистильованої води, додають 10 см3 концентрованої сірчаної кислоти питома вага 1,84, доводять об'єм до 1 дм3. 1 см розчину містить 0,1 мг заліза.
2.)Приготування стандартного (робочого) розчину
Основний розчин розбавляють в 10 раз дистильованою водою (готують в день виконання аналізу). Для цього 10 см3 основного стандартного розчину, взятого мірною піпеткою на 10 см3 переносять в мірну колбу на 100 см3 і доводять об'єм до мітки дистильованою водою. Розчин ретельно перемішують. 1 см3 розчину містить 0,01 мг заліза.
Побудова колібрувального графік.
В мірні колби на 50 см відміряють: 0; 0,5; 1; 2; 3; 4 та 5 см3 робочого стандартного розчину залізо амонійних квасців і доводять об'єм до мітки дистильованою водою.
Вміст заліза в серії стандартних розчинів складає: 0-0,1-0,2-0,4-0,6-0,8-1 мг/дм3.
До стандартних розчинів і контрольної проби додають по 1 см3 розчину соляної кислоти (1:1) і декілька кристаликів персульфату амонію, розчин перемішують.
Після перемішування в колби вводять по 1см3 50%-го розчину роданіду калію, знову перемішують, визначають оптичну щільність розчинів, після чого будують колібровочний графік залежності оптичної щільності від концентрації заліза в міліграмах на дециметр кубічний (із знайдених значень розраховують оптичну щільність контрольної проби, якщо користуються колориметром старого зразку).
При вимірюванні інтенсивності кольору користуються синьо-зеленим світлофільтром (X = 500 нм), товща шару робочого розчину 2-5 см.
Аналітичний контроль зразку води
В мірну колбу на 50 чи 100 см3 (завдає викладач) наливають до мітки досліджувану воду, додають 1см3 соляної кислоти (1:1), декілька кристаликів персульфату амонію, перемішують, потім додають 50%-ний розчин роданіду калію. Після перемішування вимірюють оптичну щільність і по колібровочному графіку знаходять відповідну їй величину кількості заліза.
Вміст заліза:
ХРе = С*50/V,
де,
С - концентрація заліза, знайдено по колібровочному графіку;
V - об'єм проби, взятої для визначення, см3.
При звичайних умовах це 50 або 100 см3. При других умовах об'єм проби може бути зменшеним або збільшеним.
3) Розрахувати вміст заліза в питній воді.
Вихідні дані:
- концентрація заліза, знайденого за калібрувальним графіком дорівнює
0,8 мг/дм3;
- об’єм проби, взятої для визначення дорівнює 100 см3.
ХРе = 0,8*50/100=0,4 (мг/см3)
6. Визначити концентрацію заліза в питній воді.
Завдання
1) Перелічити основні реактиви та посуд для визначення вмісту заліза в питній воді.
1. Стандартний (основний) розчин залізоамонійних квасців, вміщаючих 0,1 мг Fе в 1 см3 розчину.
2. Стандартний (робочий) розчин залізоамонійних квасців, вміщаючих 0,01 мг Fе в 1см3 розчину.
3. Роданід калію чи амонію, 50%-ний розчин.
4. Персульфат амонію чи калію в кристалах.
5. Соляна кислота (1:1), вільна від заліза.
6. Колби мірні місткістю 50 см3 (8 штук).
7. Колби конусні місткістю 100 см3 (2 шт.).
8. Чашки фарфорові на 100 см3 (2 шт.).
9. Лійки (2 шт.).
10. Шпатель.
11. Папір фільтрувальний.
12. Кислота сірчана концентрована.
13. Фотоколориметр КФК - 2МП.
14. Електрична плитка. Сушильна шафа.
15.Терези ВЛР-200г.
16.Витяжна шафа.
2) Описати методику приготування основного та робочого розчинів.
Підготовчі роботи. Приготування реактивів
1.)Приготування стандартного (основного) розчину залізоамонійних квасців.
Беруть наважку Fe(NH4) (SO4)2 *12Н20 0,8634 г, розчиняють в невеликій кількості дистильованої води, додають 10 см3 концентрованої сірчаної кислоти питома вага 1,84, доводять об'єм до 1 дм3. 1 см розчину містить 0,1 мг заліза.
2.)Приготування стандартного (робочого) розчину
Основний розчин розбавляють в 10 раз дистильованою водою (готують в день виконання аналізу). Для цього 10 см3 основного стандартного розчину, взятого мірною піпеткою на 10 см3 переносять в мірну колбу на 100 см3 і доводять об'єм до мітки дистильованою водою. Розчин ретельно перемішують. 1 см3 розчину містить 0,01 мг заліза.
Побудова колібрувального графік.
В мірні колби на 50 см відміряють: 0; 0,5; 1; 2; 3; 4 та 5 см3 робочого стандартного розчину залізо амонійних квасців і доводять об'єм до мітки дистильованою водою.
Вміст заліза в серії стандартних розчинів складає: 0-0,1-0,2-0,4-0,6-0,8-1 мг/дм3.
До стандартних розчинів і контрольної проби додають по 1 см3 розчину соляної кислоти (1:1) і декілька кристаликів персульфату амонію, розчин перемішують.
Після перемішування в колби вводять по 1см3 50%-го розчину роданіду калію, знову перемішують, визначають оптичну щільність розчинів, після чого будують колібровочний графік залежності оптичної щільності від концентрації заліза в міліграмах на дециметр кубічний (із знайдених значень розраховують оптичну щільність контрольної проби, якщо користуються колориметром старого зразку).
При вимірюванні інтенсивності кольору користуються синьо-зеленим світлофільтром (X = 500 нм), товща шару робочого розчину 2-5 см.
Аналітичний контроль зразку води
В мірну колбу на 50 чи 100 см3 (завдає викладач) наливають до мітки досліджувану воду, додають 1см3 соляної кислоти (1:1), декілька кристаликів персульфату амонію, перемішують, потім додають 50%-ний розчин роданіду калію. Після перемішування вимірюють оптичну щільність і по колібровочному графіку знаходять відповідну їй величину кількості заліза.
Вміст заліза:
ХРе = С*50/V,
де,
С - концентрація заліза, знайдено по колібровочному графіку;
V - об'єм проби, взятої для визначення, см3.
При звичайних умовах це 50 або 100 см3. При других умовах об'єм проби може бути зменшеним або збільшеним.
3) Розрахувати вміст заліза в питній воді.
Вихідні дані:
- концентрація заліза, знайденого за калібрувальним графіком дорівнює
1,0 мг/дм3;
- об’єм проби, взятої для визначення дорівнює 110 см3.
ХРе = 1,0*50/110=0,45 (мг/см3)
7. Визначити свинець у ґрунті полярографічним методом.
Завдання
1) Перелічити основні реагенти і апаратуру для визначення свинцю у ґрунті за допомогою полярографу.
2) Описати методику відбору проб ґрунту.
3) Розрахувати концентрацію свинцю у ґрунті полярографічним методом.
Вихідні дані:
- концентрація свинцю у полярографічній чарунці, визначена за калібрувальним графіком дорівнює 8,5 мкг/мл;
- вага ґрунту, взятого для аналізу дорівнює 10 г;
- загальний об’єм ґрунту дорівнює 100 мл.
8. Визначити свинець у ґрунті полярографічним методом.
Завдання
1)Перелічити основні реагенти і апаратуру для визначення свинцю у ґрунті за допомогою полярографу.
Реагенти і апаратура
1.Полярограф універсальний ПУ-1.
2.Полярографічна чарунка (комплект), аноди, насичений каломельний електрод, капіляр, який має t > 5,0 сек.
3.Балон зі стиснутим газом: аргон або азот.
4.Муфельна піч.
5.Ексикатор.
6.Тиглі порцеляновані.
7.Лійки для фільтрування сі=3-5 см.
8.Мірні циліндри і градуйовані пробірки на 100 мл.
9.Ступка.
10.Фільтри беззольні.
11.Колби мірні на 100 мл, 1000мл.
12.Свинець металевий, ч.д.а.
13.Соляна кислота, конц. питом. вага 1,9 і 20% розчин.
14.Азотна кислота, х. ч. розбавлена (3:2).
15.Сірчана кислота, х. ч. концентрована, питома вага 1,84.
16.Стандартний розчин, який містить 10 мкг свинцю на мл.
2)Описати методику відбору проб ґрунту.
Принцип і характеристика методу. Методика основана на здатності іонів свинцю (Рb2+) відновлюватися на ртутному крапельному електроді. Метод дозволяє визначити 0,5 мкг свинцю у пробі. Аналізу заважають іони кадмію (Сd2+) та міді (Сu2+), коли їх концентрація перевищує концентрацію визначених іонів свинцю (Рb2+) у 100 разів; інші домішки аналізу не заважають.
Наважку 0,1 г свинцю вміщують у конічну колбу ємністю 250 мл і доливають 20 мл розбавленої (3:2) азотної кислоти.
Після розчинення домішку розчин упарюють до невеликого об'єму (3-5мл), доливають 15мл соляної кислоти (питома вага 1,19) і операцію повторюють ще 2-3 рази, після чого доливають 20 мл 20%-ої соляної кислоти, нагрівають до одержання прозорого розчину хлориду свинцю; розчин переносять кількісно у мірну колбу ємністю 1 мл неодноразово, обполіскуючи колбу 20%-ою соляною кислотою і додають до основного розчину. Доводять розчин до мітки 20%-ої соляної кислоти і ретельно перемішують. Потім 10 мл цього розчину переносять піпеткою у мірну колбу на 100 мл, доводять до мітки дистильованою водою і перемішують.
Одержаний розчин 10 мкг на 100мл, або 10 мг на 1 л свинцю.
Відбір проб
Відбір проб ґрунту краще робити два рази на рік: весною після звільнення землі від снігу і восени, після збору врожаю. Для визначення точок відбору проб застосовується азимутальний метод, проби відбираються навколо джерела забруднення.
Відстань точок відбору проб грунту від джерела забруднення (від огорожі промислового підприємства) складає 0,5; 1; 2; 5; 10; 20; 30; 50 км і на ділянці не підданій його впливу. Кількість точок відбору проб та їх відстань від джерела забруднення визначається цілями (метою) дослідження і дальністю розповсюдження забруднення.
Положення точок відбору проб спочатку відмічається на карті. Відмічені точки служать опорними пунктами при виборі місця відбору проб. Навколо заздалегідь фіксованих точок вибирається площадка розміром приблизно 2 га (200x100). Площадка повинна бути однорідною по ґрунтовому покриву і рослинності. Не слід брати проби у місцях, де поверхня ґрунту або рослинність явно відрізняються від основного фону площадки.
З вибраної площадки відбирається змішаний зразок ґрунту, складений з п'яти проб, взятих за методом конверту (по кутам площадки і в центрі).
Проби відбираються лопатою або буром на глибині одного шару (до 20-25 см). Грунт обрізають лопатою у вигляді прямокутної частини, слідкують за тим, щоб у кожний зразок потрапила приблизно така ж кількість ґрунту його верхнього і нижнього шару, яка пропорційна його потужності. Взятий зразок старанно перемішують на листі фанери або на шматку брезенту, поліетиленовій плівці.
Потім для складання змішаної проби з нього відбирають якою-небудь міркою (наприклад, стакан, банка) невеликий об'єм ґрунту і висипають у чистий мішечок. З усіх окремих зразків у змішану середню пробу повинна потрапити приблизно однакова кількість ґрунту. Всі п'ять проб зсипають разом, звільняють від каменів, коренів та інших включень і старанно перемішують.
Після перемішування із загальної маси методом картування (поділ на чотири частини і взяття однієї з них) відбирається 1,0-1,5 кг ґрунту, який зсипається у паперовий або поліетиленовий мішечок.
Проба запаковується і маркується. Заповнюється супроводжуваний талон, разом з яким проба відсилається у лабораторію на аналіз.
Для вивчення розподілу концентрації металів у ґрунті по глибині проби відбираються з ґрунтових розрізів, зроблених до глибини 1 м шаром 0-25 і 75-100 см (у разі більш поглибленого вивчення міграції металів по профілю ґрунту проби доцільно
відбирати до глибини 1,5-2,0м по генетичним горизонтам).
Відібрані по шарам проби ґрунту обробляються також, як і
поверхневі проби.
Хід аналізу
Проби ґрунту, які надійшли у лабораторію, висушують до сухого стану. Після висушування проба ґрунту перетирається у великій порцеляновій ступці (без особливих зусиль) і просіюється через алюмінієве або капронове сито з розміром отворів 1-2 мм. Не просіяні грудки ґрунту розтирають і знову просіюють, і так декілька разів. Із подрібненої таким чином проби методом квартування береться середня проба - приблизно 200-300 г.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 245; Нарушение авторских прав?; Мы поможем в написании вашей работы!