
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Симметричные димеры ДНК-связывающих белков часто узнают симметричные последовательности
|
|
|
|
нуклеотидов [8]
Для определения трехмерной структуры белка обычно необходим дифракционный рентгеноструктурный анализ больших кристаллов, получение которых часто представляет собой нелегкую задачу. Один из первых регуляторных белков, изученных таким методом - сго-белок бактериофага лямбда. Это небольшой белок (66 аминокислотных остатков), который не имеет «цинковых пальцев», однако, связывается с кластером специфических последовательностей ДНК, каждая из которых содержит
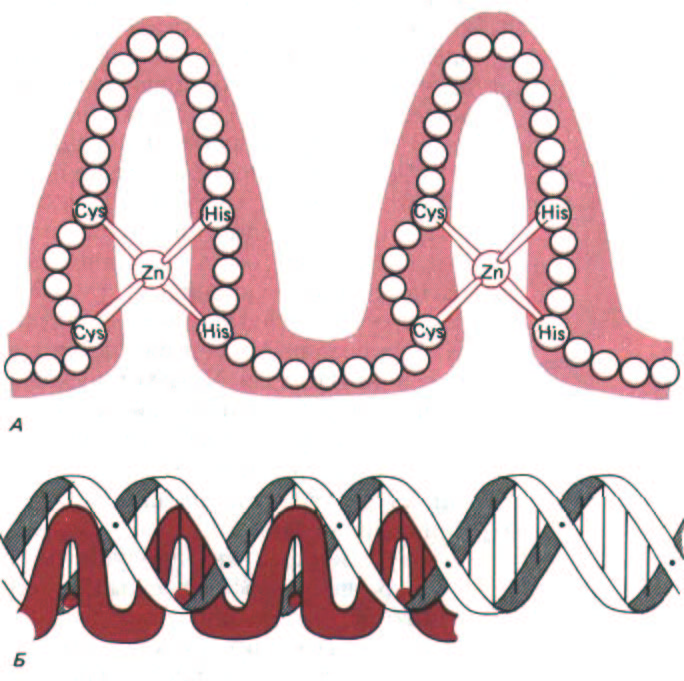
Рис. 9-10. Семейство сайт-специфических ДНК-связывающих белков типа «цинковые пальцы» А. Упрощенная схема строения ДНК-
связы-вающего домена; кружочками обозначены отдельные аминокислоты. В настоящее время считается, что полипептидная цепь, образующая каждый «палец», имеет сложную глобулярную структуру. Б. Схема взаимодействия четырех «цинковых пальцев» с последовательностью ДНК.
Согласно этой модели, каждый палец узнает определенную последовательность, состоящую примерно из пяти нуклеотидных пар. (С изменениями из A. Klug, D. Rhodes, Trends in Biochem. Sci. 12: 464-469, 1987.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
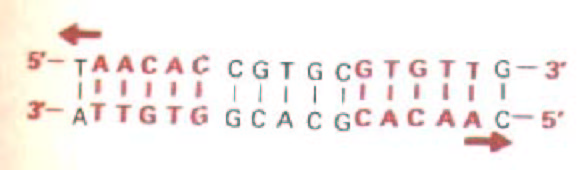
Рис. 9-11. Специфическая последовательность ДНК, узнаваемая сrо-белком бактериофага лямбда. Выделенные цветом нуклеотиды в этой последовательности расположены симметрично, что позволяет половине димерного белка распознавать каждую половину данного сайта.
по 17 нуклеотидных пар. Одна из этих последовательностей приведена на рис. 9-11. Выделенная цветом часть последовательности является симметричной, т.е. при повороте спирали ДНК на 180° она не изменится. Симметрией обладают и многие участки связывания сайт-специфических белков. Такую симметрию можно объяснить исходя из структуры сrо-белка, определенной методом дифракции рентгеновских лучей.
Сrо-белок представляет собой симметричный гомодимер, который связывается с ДНК способом, изображенным на рис. 9-12. В связи с тем, что ось симметрии второго порядка последовательности белка расположена на оси симметрии второго порядка последовательности ДНК, каждая из одинаковых половин димера может образовывать одинаковые связи с теми нуклеотидными парами ДНК, которые она узнает. Во всех случаях, когда последовательность связывающего сайта ДНК симметрична, белок, узнающий ее, скорее всего оказывается димером или симметричным образованием большего размера.
9.1.11. Сrо-белок принадлежит к семейству ДНК-связывающих белков, построенных по принципу «спираль-виток-
спираль» [9]
Сайт мономера белка его, контактирующий с ДНК, образован последовательностью из 20 аминокислот, формирующих две α-спирали, которые разделены коротким витком. Такой фрагмент спираль-виток-спираль обнаружен и у ряда других бактериальных сайт-специфических ДНК-свя- зывйющих белков, трехмерные структуры которых известны (рис. 9-13). Более того, анализ аминокислотных последовательностей (обнаруженная при этом гомология) свидетельствует о том, что такой фрагмент присутствует и в составе других белков, участвующих в регуляции активности генов у бактерий, дрожжей и дрозофилы.
Все белки, содержащие структуру спираль-виток-спираль, изображенные на рис. 9-13, представляют собой симметричные гомодимеры.
Одна из α-спиралей в каждом мономере, называемая узнающей, располагается в большой бороздке, где выступающая часть ее аминокислотной последовательности образует водородные связи с определенными основаниями ДНК. Важно, что две идентичные узнающие спирали в димере разделены только одним витком цепи ДНК (3,4 нм). Такое разделение дает возможность каждой узнающей спирали одинаковым образом взаимодействовать с симметрично расположенными парами оснований в участке связывания (рис. 9-14).

Рис. 9-12. Схема связывания сrо-белка бактериофага лямбда с ДНК. Белок представляет собой симметричный гомодимер, который связывается с симметричной последовательностью ДНК, представленной на рис. 9-11. Способ связывания с ДНК определен путем анализа молекулярных моделей. А. Проволочная модель молекулы белка, совмещенная со схематическим изображением двойной спирали ДНК. Б.
Пространственная модель ДНК-белкового комплекса, показанного на А. На этой модели каждая аминокислота в белковой цепи изображена в виде сферы; цветные шары представляют остов ДНК. (С любезного разрешения Brian W. Matthews по W. F. Ander-son, D. H. Ohlendorf, Y. Takoda and B.
W. Matthews, Nature 290: 754-758, 1981, © 1981, Macmillan Journals Ltd.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
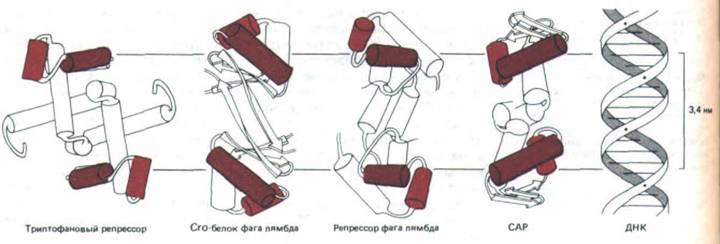
Рис. 9-13. Семейство димерных ДНК-связывающих белков. Эти регуляторные белки работают в бактериальных системах: репрессор лямбда и cro-белок контролируют экспрессию генов бактериофага лямбда, а белок активатор катаболизма (САР) регулирует экспрессию ряда генов Е. coli, которые могут включаться лишь в отсутствие глюкозы. В каждом случае рентге-ноструктурный анализ выявил наличие двух копий узнающей спирали (коричневый цилиндр), разделенных одним витком спирали ДНК (3,4 нм).
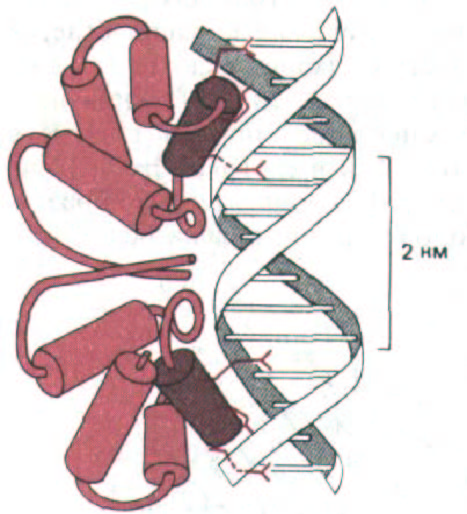
Рис. 9-14. Спаривание боковой цепи аминокислот с парами оснований ДНК при узнавании нуклеотидной последовательности регуляторним белком-репрессором, влияющим на активность гена бактериофага 434. Комплекс ДНК с этим белком изучали методом рентгеноструктурного анализа. (С изменениями из J. Е. Anderson, M. Ptashne and S.C. Harrison, Nature 326: 846-852, 1987.)
Молекула аллостерического эффектора, связываемая белком такого типа, может значительно повышать или снижать его сродство с ДНК, меняя расстояние между двумя узнающими спиралями. Аналогичным образом аллостерические эффекторы могут изменять сродство с ДНК других типов белков, регулирующих активность генов. Подобные изменения имеют большое значение при включении и выключении генов в ответ на изменения в окружающей среде (см. разд. 10.2.10).
9.1.12. Молекулы белков при связывании с ДНК частоконкурируют или кооперируются друг с другом [10]
Большинство генетических процессов зависит от взаимодействия между молекулами белков, которые одновременно связываются с близлежащими сайтами ДНК. В простейшем случае два сайт-специфических белка, участки связывания которых частично или полностью перекрываются, конкурируют друг с другом за место на спирали ДНК (рис. 9-15, А). Например, белок-репрессор может подавлять транскрипцию гена, блокируя связывание активирующего белка с ДНК. Однако белки могут и помогать друг другу более прочно удерживаться на ДНК. Такое кооперативное связывание может происходить как между двумя различными молекулами белка (рис, 9-15, Б), так и между двумя копиями молекул одного типа. В последнем случае белки, как правило, связываются по типу «все или ничего» и образуют на ДНК кластеры. При повышении концентрации этих белков, их связывание с ДНК резко возрастает (рис. 9-15, В). В качестве примера кооперативно связывающихся белков такого типа можно привести спираль-дестабилизируюгций белок, белок гесА (гл. 5) и гистон H1.
Механизм взаимодействия при кооперативном и конкурентном связывании на примере двух различных сайт-специфических ДНК-
связывающих белков будет обсуждаться дальше в связи с проблемой регуляции транскрипции (гл. 10).
9.1.13. Геометрия спирали ДНК зависит от последовательности нуклеотидов [11]
В течение 20 лет после открытия двойной цепи ДНК в 1953 г. полагали, что эта молекула имеет одинаковую структуру на всем своем протяжении, причем поворот спирали между соседними парами оснований составляет точно 36° (10 нуклеотидных пар на поворот спирали).
Последующие эксперименты выявили, что ДНК гораздо более полиморфна, а варианты ее формы определяются последовательностью
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
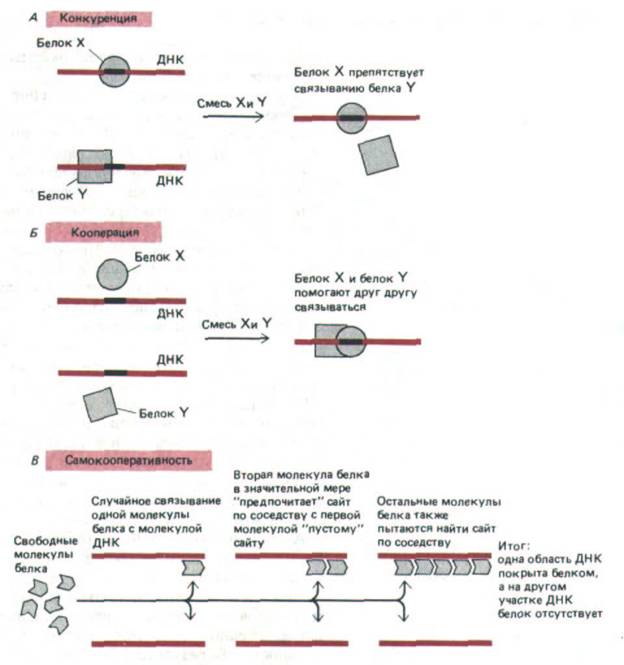
Рис. 9-15. Примеры конкурентного и кооперативного взаимодействия при связывании белков с ДНК. А. Конкуренция происходит, когда связывание белков X и Y со специфическими сайтами ДНК взаимно исключается. Б. Кооперация имеет место, если связывание одного белка с ДНК повышает сродство другого белка к близлежащему сайту. В. Самокооперативность приводит к связыванию отдельного белка в виде кластера молекул, в результате связывание с какой-либо областью ДНК происходит по типу «все или ничего».

Рис. 9-16. Три формы спирали ДНК, каждая из которых содержит 22 нуклеотидные пары. Все эти структуры образованы двумя антипараллельными цепями ДНК, которые удерживаются вместе благодаря спариванию комплементарных нуклеотидов. Каждая форма показана сбоку и сверху. Сахарно-фосфатный остов и пары оснований выделены разными оттенками серого: темно-серым и светло-серым, соответственно. А.
В-форма ДНК, которая чаще всего встречается в клетках. Б. А-форма ДНК, которая становится преобладающей при высушивании любой ДНК, независимо от ее последовательности. В. Z-форма ДНК: такую форму приобретают некоторые последовательности при определенных условиях. В-
форма и А-форма-правоза-крученные, а Z-форма -левозакру-ченная (см. рис. 3-4). (С любезного разрешения Richard Feldmann.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
нуклеотидов. Форма спирали оказывает значительное влияние на ее взаимодействие с белками.
Существует несколько типов спирали ДНК, причем в некоторых случаях изменения в ее структуре оказываются весьма значительными.
Самая стабильная форма ДНК - это правозакрученная спираль В-формы (рис. 9-16, А). Изучение рассеяния рентгеновских лучей показало, что небольшие области последовательности образуют правозакрученную спираль, отличающуюся от В-формы и известную как А-форма ДНК. Для этой формы характерен более сильный наклон оснований, в результате чего спираль оказывается более короткой и более широкой, чем в случае В-
формы (рис. 9-16, Б). Вероятно, в некоторых случаях это имеет большое значение, например, когда нить ДНК спаривается с РНК в затравочной части фрагментов Оказаки (дополнительная гидроксиль-ная группа рибозы не позволяет спирали РНК-ДНК образовывать В-форму). По тем же причинам А-форму имеет и спираль РНК-РНК. А-форма характерна для спиральных областей шпилечных структур всех одноцепочечных РНК и, следовательно, чрезвычайно важна для жизнедеятельности клетки. Биологическая роль третьей спиральной формы ДНК менее ясна.
Последовательности ДНК, состоящие из чередующихся пуринов и пиримидинов (GCGCGCGC) легко образуют левозакручен-ную двойную спираль, известную как Z-форма ДНК (рис. 9-16, В). Считается, что короткие области с такой структурой редко встречаются в хромосоме. Можно предположить, однако, что они особым образом распознаются белками, а значит, тоже способны играть существенную роль в жизнедеятельности клетки.
А- и Z-формы ДНК, которые сильно отличаются от стабильной В-структуры, весьма редки, но менее сильные изменения В-цепи являются обычными, и, несомненно, имеют важное биологическое значение. У нуклеиновых кислот, находящихся в В-форме, наклон оснований и угол поворота спирали между их парами существенно зависят от того, какие именно нуклеотиды соседствуют друг с другом в последовательности.
В результате атомы спирали отклоняются от идеального положения. Даже ДНК-связывающие белки, которые не обладают способностью специфически узнавать определенные нуклеотидные пары, могут «чувствовать» такие искажения.
Значение вариаций в структуре ДНК-спирали для связывания сайт-cпецифических белков четко показано на примере репрессора бактерио-
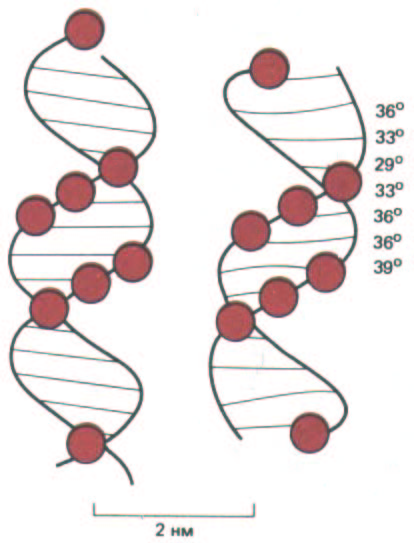
Рис. 9-17. Сравнение конформации ДНК в составе комплекса с репрессором бактериофага 434 (справа) с идеальной спиралью В-формы (слева). Фосфаты ДНК, контактирующие с белком, обозначены цветными кружочками. Углы, образующиеся при повороте спирали между парами оснований, указаны для искаженной спирали. Считается, что отклонения от идеальной спирали необходимы для более тесного связывания белка.
Энергия связывания частично зависит от «неспецифического» взаимодействия между NH-группами и фосфатами ДНК. Такие, способствующие связыванию контакты, может образовывать лишь несколько искаженная спираль В-формы: середина малой бороздки в области связывающего сайта должна быть слегка сужена, и спираль немного изогнута. Поскольку для получения такого изгиба и уплотнения спирали в центральной области должны присутствовать АТ-пары, их замена на GC значительно ослабляет связывание белков. Таким образом, пары оснований, расположенные в центре, узнаются репрессором даже если белок не контактирует непосредственно с этими основаниями (см. также рис. 9-14). (С изменениями из J.E.
Anderson, M. Ptashne and S.C Harrison, Nature 326: 846-852, 1987.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
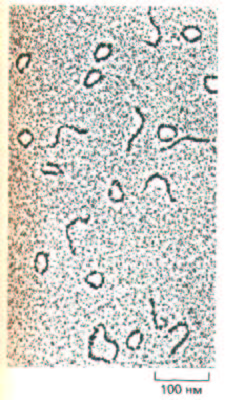
Рис. 9-18. Электронная микрофотография фрагментов, несущих сильно изогнутый сегмент спирали ДНК. Фрагменты ДНК, выделенные из миниколец кинетопластов трипаносоми Crithidia fasciculata содержит всего лишь 200 пар нуклеотидов, однако некоторые из них изогнуты так, что весь фрагмент замыкается в кольцо. Нормальная спираль ДНК такой длины может при изгибе образовать в среднем лишь четверть кольца (один равномерный правый виток). (По J. Griffith, М. Bleyman, С. A. Rauch, P. A. Kitchin and P. T. Englund, Cell 46: 717-724, 1986.)
фага X. С помощью рентгеноструктурного анализа установлено, что ДНК при связывании с этим белком приближается к идеальной В-форме (рис.
9.17).
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 2247; Нарушение авторских прав?; Мы поможем в написании вашей работы!