
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Подходы к исследованию эмоциональной сферы личности в трудах ученых
|
|
|
|
ДОКЛАД
260200, 260800, 280700, 190302
1. Протонно-нейтронная теория строения атомного ядра. Изотопы, изобары.
2. Распределение электронов в атомах элементов. Принцип Паули. Правило Гунда. Принцип наименьшей энергии. Напишите электронные формулы атомов элементов с порядковыми номерами 22 и 35.
3. Характеристика электронов четырьмя квантовыми числами. Принцип Паули. Правило Гунда. Принцип наименьшей энергии. Периодическая система Д. И. Менделеева и электронное строение атомов. Приведите примеры.
4. Относительные атомные и молекулярные массы. Молярная масса. Моль как мера количества вещества. Закон Авогадро. Молярный объем газа при нормальных условиях.
5. Основные законы химии. Закон сохранения массы и энергии, закон постоянства состава, закон Авогадро, закон эквивалентов.
6. Эквивалент, молярная масса эквивалента. Закон эквивалентов. Определение эквивалентов и молярных масс эквивалентов элементов, оксидов, гидроксидов, кислот и солей. Приведите примеры расчетов.
7. Структура периодической системы Д.И.Менделеева. Энергия ионизации, сродство к электрону, электроотрицательность. Изменение химических свойств элементов в периодах и группах.
8. Современная формулировка периодического закона Д.И.Менделеева. Сущность периодического закона в свете современной теории строения атома. Электронные семейства: s-, p-, d- и f-элементы. Их краткая характеристика. Приведите примеры.
9. Периодический закон Д.И.Менделеева. Строение периодической системы. Изменение металлических и неметаллических свойств элементов по периодам и группам. S-, p-, d- и f-электронные семейства, их характеристика. Приведите примеры.
10. Типы химической связи: ионная, ковалентная, донорно-акцепторная, металлическая связь. Приведите примеры.
11. Типы химической связи. Ковалентная химическая связь. Ее свойства: насыщаемость, направленность, поляризуемость. Приведите примеры.
12. Донорно-акцепторная химическая связь. Строение комплексных соединений. Комплексообразователь, лиганды, координационное число. Диссоциация комплексных соединений. Константа нестойкости.
13. Экзотермические и эндотермические химические реакции. Закон термохимии Гесса. Расчеты теплового эффекта химических реакций. Энтальпия. Понятие об изобарно-изотермическом потенциале и энтропии.
14. Скорость химических реакций. Факторы, влияющие на скорость реакции. Закон действующих масс. Правило Вант-Гоффа. Константа скорости реакции.
15. Обратимые химические реакции. Химическое равновесие, константа химического равновесия. Смещение химического равновесия. Принцип Ле Шателье.
16. Растворы неэлектролитов. Упругость пара чистого растворителя и раствора. Температура замерзания и кипения растворов. Определение молекулярной массы вещества методами криоскопии и эбулиоскопии.
17. Электролитическая диссоциация. Степень диссоциации. Сильные и слабые электролиты, примеры. Напишите молекулярное и ионно-молекулярное уравнения реакций взаимодействия гидроксида аммония и хлорида железа (III).
18. Вода как электролит. Ионное произведение воды. Водородный показатель. Шкала рН для нейтрального, кислого и щелочного растворов.
19. Слабые электролиты. Степень диссоциации и константа диссоциации. Закон разбавления Оствальда. Влияние добавления одноименного иона на диссоциацию слабого электролита.
20. Гидролиз солей. Факторы, влияющие на гидролиз. Случаи гидролиза различных типов солей. Приведите примеры гидролиза по катиону и по аниону. Изменение рН раствора при гидролизе.
21. Жесткость воды. Временная и постоянная жесткость. Методы ее устранения.
22. Окислительно-восстановительные реакции. Степень окисления и ее определение. Классификация окислительно-восстановительных реакций. Сильные окислители и восстановители.
23. Понятие об электродных потенциалах. Ряд напряжений металлов. Разберите работу медно-цинкового гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. ЭДС гальванического элемента. Уравнение Нернста.
24. Коррозия металлов. Химическая и электрохимическая коррозия. Процессы, происходящие на электродах микрогальванического элемента при коррозии технического цинка в кислой среде. Защита металлов от коррозии.
25. Понятие о катализе. Механизм действия катализаторов. Роль адсорбции в гетерогенном катализе.
1. Водород. Строение атома и степени окисления. Гидриды. На основании электронных уравнений расставьте коэффициенты в реакции:
 KH + H2O H2 + KOH
KH + H2O H2 + KOH
2. Бериллий. Строение атома и степени окисления. Оксид, гидроксид, соли. Отношение к кислотам и щелочам. Напишите уравнения реакций, которые необходимо провести для осуществления следующих превращений:


 Be Be(NO3)2 Be(OH)2 K2[Be(OH)4]
Be Be(NO3)2 Be(OH)2 K2[Be(OH)4]
3. Магний. Строение атома и степени окисления. Оксид, гидроксид, соли. Отношение к кислотам. Закончите уравнение реакции и уравняйте его методом электронного баланса:
 Mg + HNO3 (очень разб.)
Mg + HNO3 (очень разб.)
4. Щелочноземельные металлы. Строение атомов и степени окисления. Оксиды, гидроксиды и соли, их применение. Жесткость воды и ее устранение. Составьте уравнения реакций для осуществления следующих превращений:



 Ca CaH2 Ca(OH)2 CaCO3 Ca(HCO3)2
Ca CaH2 Ca(OH)2 CaCO3 Ca(HCO3)2
5. Бор. Строение атома и степени окисления. Оксид бора и борная кислота. Соли бора и их применение в текстильной и легкой промышленности. На основании электронных уравнений расставьте коэффициенты в реакции:
 B + HNO3 H3BO3 + NO2
B + HNO3 H3BO3 + NO2
6. Углерод. Строение атома и степени окисления. Оксиды, водородные соединения. Угольная кислота и ее соли. Жесткость воды и методы ее устранения.
7. Азот. Строение атома и его степени окисления. Соединения азота с водородом. Синтез аммиака. Применение. Составьте электронные уравнения и расставьте коэффициенты в реакции:
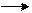 NH4NO3 N2O + H2O
NH4NO3 N2O + H2O
8. Азот. Строение атома и степени окисления. Оксиды, кислоты. Азотная кислота. Строение молекулы. Кислотные и окислительные свойства. Действие азотной кислоты на металлы и неметаллы. Закончите уравнения реакций и расставьте коэффициенты, используя метод электронного баланса:

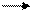 Ag + HNO3(разб.) Cu + HNO3(конц.)
Ag + HNO3(разб.) Cu + HNO3(конц.)
9. Фосфор. Строение атома и степени окисления. Соединения с водородом, оксиды, фосфорные кислоты и их соли. Фосфорные удобрения. На основе метода электронного баланса расставьте коэффициенты в уравнении реакции:
 P + HNO3 + H2O H3PO4 + NO
P + HNO3 + H2O H3PO4 + NO
10. Кислород. Строение атома и степени окисления. Перекись водорода и ее свойства. Расставьте коэффициенты в реакции, используя метод электронного баланса:
 KMnO4 + H2O2 + H2SO4 MnSO4 + O2 + K2SO4 + H2O
KMnO4 + H2O2 + H2SO4 MnSO4 + O2 + K2SO4 + H2O
11. Сера. Строение атома и степени окисления. Сероводород и сероводородная кислота, ее соли. На основании электронных уравнений расставьте коэффициенты в уравнении реакции, протекающей по схеме:
 H2S + K2Cr2O7 + H2SO4 S + Cr2(SO4)3 + K2SO4 + H2O
H2S + K2Cr2O7 + H2SO4 S + Cr2(SO4)3 + K2SO4 + H2O
12. Сера. Строение атома и степени окисления. Оксиды и кислоты. Серная кислота, строение молекулы, получение и свойства. Действие серной кислоты на металлы и неметаллы. Напишите уравнения реакций взаимодействия концентрированной серной кислоты с медью, цинком. Уравняйте их с помощью метода электронного баланса.
13. Подгруппа серы. Строение атомов и степени окисления. Соединения с водородом. Оксиды и кислоты. Окислительно-восстановительные свойства соединений. Закончите уравнение реакции и вычислите коэффициенты, используя метод электронного баланса:
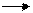 Ag + H2SO4 (конц.)
Ag + H2SO4 (конц.)
14. Сера. Строение атома и степени окисления. Оксиды, кислоты. Сернистая кислота, кислотные и окислительно-восстановительные свойства. Соли. Составьте электронные уравнения и расставьте коэффициенты в реакции:
 K2SO3 K2S + K2SO4
K2SO3 K2S + K2SO4
15. Галогены. Строение атомов и степени окисления. Водородные и кислородные соединения галогенов на примере хлора. На основании электронных уравнений расставьте коэффициенты в реакции:
 Cl2 + KOH(горячий раствор) KCl + KClO3 + H2O
Cl2 + KOH(горячий раствор) KCl + KClO3 + H2O
16. Бром и иод. Строение атомов и степени окисления. Галогенводородные кислоты и их соли, получение и применение. Оксиды и кислородсодержащие кислоты. На основании электронных уравнений расставьте коэффициенты в реакции:
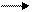 I2 + H2S S + HI
I2 + H2S S + HI
17. Подгруппа инертных элементов. Строение атомов и степени окисления. На основании электронных уравнений расставьте коэффициенты в реакции:
 KI + XeF4 I2 + Xe + KF
KI + XeF4 I2 + Xe + KF
18. Подгруппа меди. Строение атомов и степени окисления. Отношение к кислотам. Оксиды, гидроксиды. Закончите уравнения реакций и расставьте коэффициенты, используя метод электронного баланса:

 Cu + HNO3(разб.); Ag + H2SO4(конц)
Cu + HNO3(разб.); Ag + H2SO4(конц)
19. Цинк. Строение атома и степени окисления. Оксид и гидроксид. Применение цинка и его соединений. На основании электронных уравнений расставьте коэффициенты в уравнениях реакций растворения цинка в концентрированной серной и разбавленной азотной кислотах.
20. Алюмингий. Строение атомов и степени окисления. Оксид и гидроксид. Закончите уравнение реакции и напишите его в ионной форме:
 Al(OH)3 + KOH
Al(OH)3 + KOH
21. Подгруппа германия. Строение атомов и степени окисления. Оксиды и гидроксиды. Полупроводниковые свойства германия и его применение. Напишите уравнения реакций, которые необходимо провести для осуществления следующих превращений:


 Pb Pb(NO3)2 Pb(OH)2 K2[Pb(OH)4]
Pb Pb(NO3)2 Pb(OH)2 K2[Pb(OH)4]
22. Хром. Строение атома и степени окисления. Оксиды, гидроксиды, кислоты. Зависимость свойств соединений хрома от степени окисления элемента. Применение соединений хрома в текстильной и легкой промышленности. На основании электронных уравнений расставьте коэффициенты в реакции:
 Cr2O3 + KOH + KClO3 K2CrO4 + KCl + H2O
Cr2O3 + KOH + KClO3 K2CrO4 + KCl + H2O
23. Марганец. Строение атома и степени окисления. Оксиды, гидроксиды, кислоты. Зависимость свойств соединений от степени окисления марганца. На основании электронных уравнений расставьте коэффициенты в реакции:
 KMnO4 K2MnO4 + O2 + MnO2
KMnO4 K2MnO4 + O2 + MnO2
24. Железо. Строение атома и степени окисления. Получение и применение. Оксиды, гидроксиды и соли: зависимость свойств соединений от степени окисления железа. Напишите уравнения реакций, которые необходимо провести для осуществления следующих превращений:
 Fe Fe(NO3)2 Fe(OH)2 Fe(OH)3
Fe Fe(NO3)2 Fe(OH)2 Fe(OH)3
25. Железо, кобальт, никель. Строение атомов и степени окисления. Отношение к кислотам. Оксиды и гидроксиды. Напишите уравнения реакций, которые необходимо провести для осуществления следующих превращений:


 Co Co(NO3)2 Co(OH)2 CoOHCl
Co Co(NO3)2 Co(OH)2 CoOHCl
Примерные задачи по дисциплине «Неорганическая химия» для подготовки бакалавров по направлениям 260200, 260800, 280700, 190302
1. Определите рН 0,01 М соляной кислоты (a = 1).
2. Определите рН 0,01 М азотной кислоты (a = 1).
3. Какой объем 30 % серной кислоты с плотностью 1,5 г/см3 необходим для приготовления 2 л 10 % серной кислоты с плотностью 1,1 г/см3?
4. До какого объема необходимо разбавить 500 см3 20 % раствора хлорида натрия с плотностью 1,152 г/см3 чтобы получить 4,5 % раствор с плотностью 1,029 г/см3?
5. Смешали 200 см3 50 % серной кислоты с плотностью 1,4 г/см3 и 300 см3 96 % серной кислоты с плотностью 1,84 г/см3. Найдите процентную концентрацию серной кислоты после смешения.
6. К 500 см3 раствора с плотностью 1,092 г/см3 и массовой долей гидроксида калия 0,1 прибавили 200 см3 раствора с плотностью 1,045 г/см3 и массовой долей гидроксида калия 0,05 и разбавили водой до 2 л. Найдите молярную концентрацию гидроксида калия в полученном растворе.
7. Раствор нитрата калия содержит 192,6 г соли в 1 л. Плотность раствора 1,14 г/см3. Определите процентную, молярную, моляльную концентрации нитрата калия и титр раствора.
8. В 750 г раствора содержится 10 г серной кислоты. Плотность раствора 1,2 г/см3. Вычислите молярную концентрацию и молярную концентрацию эквивалента серной кислоты.
9. Вычислите молярную концентрацию, молярную концентрацию эквивалента и титр раствора с массовой долей ортофосфорной кислоты 0,4 и плотностью 1,24 г/см3.
10. Определите молярную концентрацию эквивалента 2М серной кислоты.
11. Какой объем 2 Н раствора гидроксида кальция необходим для нейтрализации 200 см3 1 Н азотной кислоты.
12. Определите эквиваленты и молярные массы эквивалентов ортофосфорной кислоты в реакциях:
H3PO4 + 3KOH = K3PO4 + 3H2O; H3PO4 + KOH = KH2PO4 + H2O
13. Укажите величины эквивалентных объемов газов: водорода, кислорода? Какой объем водорода при нормальных условиях выделится при растворении в разбавленной серной кислоте 6 г металла, молярная масса эквивалента которого равна 12 г/ моль?
14. Какой объем ацетилена можно получить при нормальных условиях при действии воды на 100 г карбида кальция, содержащего 4 % примесей?
15. Какой объем диоксида углерода при нормальных условиях образуется при разложении 150 г мела (CaCO3), имеющего 6 % некарбонатных примесей?
16. К 1м3 жесткой воды прибавили 132,5г карбоната натрия. На сколько понизилась жесткость этой воды?
17. Напишите выражение для скорости реакции растворения магниевых опилок в соляной кислоте. Как изменится скорость реакции при увеличении концентрации кислоты в 3 раза?
18. Как изменится скорость химической реакции, протекающей в газовой фазе, при уменьшении температуры на 40о С, если температурный коэффициент равен 3?
19. Напишите выражение для константы равновесия системы H2 + I2 ↔ 2HI. В какую сторону сместится равновесие системы при увеличении концентрации водорода? Иодистого водорода?
20. Напишите термохимическое уравнение реакции горения метана, в результате которой образуются пары воды и газообразный диоксид углерода. Вычислите ΔН этой реакции, если ΔHo298CH4 = -84,67 кДж/моль, ΔHo298CО2 = -393,51 кДж/моль, ΔHo298Н2О(г) = -241,83 кДж/моль.
21. Вычислите температуру кипения 5 % раствора нафталина С10Н8 в бензоле, если температура кипения чистого бензола равна 80,2о С, а эбулиоскопическая константа его 2,57.
22. Гальванический элемент имеет схему:
Ag | 0,1M AgNO3 || 0,001M AgNO3 | Ag. Определите анод и катод и вычислите ЭДС данного гальванического элемента, напишите электронные уравнения анодного и катодного процессов.
23. Вычислите ЭДС гальванического элемента, имеющего следующую схему:
(—) Co | CoSO4 || CuSO4 | Cu (+) при концентрации [Со2+] = 0,01 моль/л, [Сu2+] = 0,001 моль/л. Составьте электронные уравнения анодного и катодного процессов.
24. Какие вещества и в каком количестве выделятся на угольных электродах при электролизе раствора нитрата калия в течение 20 минут при силе тока 1А? Напишите электронные уравнения анодного и катодного процессов.
25. Какой газ и в каком объеме выделится на аноде при электролизе раствора хлорида натрия при силе тока 6 А в течение 1 час?
По дисциплине «Педагогика индивидуальности»
На тему: «Эмоциональная сфера»
Выполнили:
Студентка магистратуры 1 курса
Дубицкая К.А.
Преподаватель:
Гребенюк Т.Б.
г. Калининград 2016 г.
План:
Введение
1. Подходы к исследованию эмоциональной сферы личности в трудах ученых.
2. Типы восприятия детьми эмоциональной сферы человека (по М.П. Щетинину).
3. Педагогические цели направленные на развитие эмоциональной сферы (О.С. Гребенюк).
4. Модель Джона Готмана по управлению эмоциональными состояниями детей.
5. Вывод.
Список лиературы
ВВЕДЕНИЕ
«Если ты с детства не научился смотреть в глаза матери и видеть в них тревогу или покой, мир или смятение, - ты на всю жизнь останешься нравственным невеждой. Нравственное невежество, как и дикость в любви, приносит людям много горя и обществу - вред.»
В.А. Сухомлинский
Маленькие дети часто находятся в «плену эмоций», поскольку еще не могут управлять своими эмоциями и чувствами, что приводит к импульсивности поведения, осложнениям в общении со сверстниками и взрослыми.
Эмоциональная сфера является важной составляющей в развитии дошкольников, так как никакое общение, взаимодействие не будет эффективным, если его участники не способны, во-первых, распознавать эмоциональное состояние другого, а во-вторых, управлять своими эмоциями.
Психолог Уильям Джемс в 1884 году изложил, а в 1894 году развил далее тезис о том, что непосредственно за восприятием возбуждающего факта следует телесное изменение, а наше переживание этих изменений и есть эмоции.
Подобную точку зрения разделял и датский исследователь К. Ланге: по его мнению, эмоции возникают в результате моторных изменений, вызываемых некоторыми раздражителями. Хотя позиции Джемса и Ланге не совсем идентичны, вследствие совпадения во времени их теорий 1885г их стали рассматривать как единую теорию, известную ныне, как «теория Джемса - Ланге».
Это физиологическая теория, которая имеет значение и поныне. Согласно ей, мы грустим, потому что льются слезы, мы сердимся, потому что наносим удар, боимся, потому что дрожим. Внешний стимул через ораны чувств достигает ствола мозга, по двигательным нервам вызывает ответную реакцию организма.
К. Изард исследует человеческие эмоции в непосредственной связи с познавательной способностью и деятельностью человека.
Теория Джемса - Ланге имеет некоторое основание для объяснения целого ряда эмоциональных ощущений, но в целом она исходит из неправильных физиологических предпосылок. Теория Джемса - Ланге послужила основой для дальнейшего изучения роли периферических факторов в возникновении эмоции (в том числе мимики — лицевой экспрессии).
Основоположник бихевиоризма Джон Уотсон отверг теорию Джемса - Ланге. И считает, что эмоции представляют собой специфический вид реакций, проявляющихся в трёх основных формах: страха, ярости, любви. Как видно Уотсон остался на позициях Джемса и Ланге, хотя и исключил из их теории интроспективные элементы.
Центральная теория эмоциональных переживаний, которая получила название «таламической теории Коннона и Барда», была выдвинута в противовес идеи отождествления эмоций с вегетативными изменениями. Согласно этой теории эмоции отождествляются с физиологическими процессами, происходящими в центральной нервной системе. Такой подход к эмоциям положил начало плодотворным исследованиям, которые привели ко многим сенсационным открытиям.
Важно отметить, что в зарубежной психологии одним из ведущих учёных в области эмоций является крупнейший американский психолог Керрол Е. Изард, который исследует человеческие эмоции во всех аспектах. К. Изард старается объяснить, каким образом эмоции образуют существенную часть человеческого сознания, познания и действия. Он подвергает анализу важнейшие теории и эмпирические исследования, чтобы приблизится к общему пониманию в отношении человеческих эмоций. К. Изард исследует человеческие эмоции в непосредственной связи с познавательной способностью и деятельностью человека.
В теории дифференциальных эмоций, доказывая центральное значение эмоций не только для развития мотивации, но и для социальной коммуникации, познания и действия, К. Изардцентрируется на отдельных эмоциях, понимаемых как переживательно-мотивационные процессы. Данная теория имеет в своей основе пять ключевых допущений:
1) десять фундаментальных эмоций образуют основную мотивационную систему человеческого существования;
2) каждая фундаментальная эмоция обладает уникальными мотивационными и феноменологическими свойствами;
3) фундаментальные эмоции, такие, как радость, печаль, гнев, стыд, ведут к различным внутренним переживаниям и различным их внешним выражениям;
4) эмоции взаимодействуют между собой: одна эмоция может активизировать, усилить или ослабить другую;
5) эмоциональные процессы взаимодействуют с побуждениями и с гомеостатическими, перцептивными, когнитивными и моторными процессами, оказывая на них влияние.
К. Изард признает за эмоциями функцию детерминант поведения в широком диапазоне. Эмоции рассматриваются и как личностные процессы, придающие смысл и значение человеческому существованию.
Эмоции, с точки зрения К. Изарда, представляют собой трехуровневый процесс, который включает: переживаемое или осознаваемое ощущение эмоций; процессы, происходящие в нервной, эндокринной, дыхательной, пищеварительной и других системах организма; поддающиеся наблюдению выразительные комплексы эмоций, в частности те, которые отражаются на лице [29].
Таким образом, можно сделать вывод, что эмоция имеет нейрофизиологический, нервно-мышечный и феноменологический аспекты.
На нейрофизиологическом уровне эмоция определяется по электрохимической активности нервной системы.
На нервно-мышечном уровне эмоция — это мимическая и пантомимическая деятельность, висцерально-эндокринные или голосовые реакции.
На феноменологическом уровне эмоция проявляется как переживание, имеющее непосредственную значимость для субъекта. Переживание эмоции может создать в сознании процесс, совершенно независимый от познавательных процессов.
К. Изард также приходит к идее о связи эмоций и переживаний, которые являются непосредственным отражением эмоции в субъективном мире личности. И в этом он идет за трехмерной концепцией чувств В. Вундта.
Отечественные психологи, такие как С.Л. Рубинштейн, А.Н. Леонтьев и другие, критиковали К. Изарда за то, что важнейшим компонентом эмоций он не рассматривал отношение субъекта к объектам, явлениям, событиям, которые в отечественной психологии рассматривают как основу эмоций.
В своем исследовании мы придерживались определения эмоциональной сферы и эмоций О.С. Гребенюка. Эмоции – особый класс психических состояний, связанных с удовлетворением или неудовлетворением потребностей. Эмоции проявляются в форме непосредственного переживания. Устойчивые эмоциональные отношения человека к явлениям действительности, отражающие их значение в связи с его потребностями и мотивами, называют чувствами. В состав эмоциональной сферы О.С. Гребенюк включает: эмоции, чувства, самооценку, тревожность.
Отечественные психологи утверждают, что эмоции – это особая форма отношения к предметам и явлениям действительности, и выделяют три аспекта этих процессов:
1. Аспект переживания (С.Л. Рубинштейн, Г.Ш. Шингаров).
2. Аспект отношения (П.М. Якобсон, В.Н. Мясищев).
3. Аспект отражения (В.К. Вилюнас, Я.М. Веккер, Г.А. Фортунатов).
Согласно первой точки зрения, специфичность эмоций заключается в переживании событий и отношений. С.Л. Рубинштейн считал, что «эмоции выражают в форме переживания отношения субъекта к окружению, к тому, что он познаёт и делает». Чувства выражают состояние субъекта и отношение к объекту. «Психические процессы, взятые в конкретной целостности, - это процессы не только познавательные, но и эффективные, эмоционально-волевые. Они выражают не только знания о явлениях, но и отношения к ним; в них отражаются не только сами явления, но и их значение, для окружающего их субъекта, для его жизни и деятельности».
Другой взгляд на определение эмоций исходит из того, что эмоции являются формой активного отношения человека к окружающему миру. П.М. Якобсон считает, что «...человек не пассивно, не автоматически отражает окружающую его действительность. Активно воздействуя на внешнюю среду и познавая ее, человек в то же время субъективно переживает своё отношение к предметам и явлениям реального мира» [63;68].
Аспект отражения предполагает, что эмоции являются специфической формой отражения значения объекта для субъекта. Г.А. Фортунатов и П.М. Якобсон определяют эмоциональные процессы, как «отражение в мозгу человека его реальных отношений, то есть отношений субъекта потребности к значимым для него объектам» [69].
|
|
|
|
|
Дата добавления: 2017-01-13; Просмотров: 1222; Нарушение авторских прав?; Мы поможем в написании вашей работы!