
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гаусс теоремасы 3 страница
|
|
|
|
Идеал газ үшін молекула-кинетикалық теорияның негізгі теңдеуі
 , (4.5)
, (4.5)
мұндағы  –молекула массы, п –молекулалар концентрациясы;
–молекула массы, п –молекулалар концентрациясы;  – газ молекулаларының ілгерілемелі қозғалысының орташа квадраттық жылдамдығы (көп жағдайда
– газ молекулаларының ілгерілемелі қозғалысының орташа квадраттық жылдамдығы (көп жағдайда 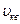 түрінде белгіленеді).
түрінде белгіленеді).
Газ молекулаларының ілгерілемелі қозғалысыныңорташа кинетикалық энергиясы:
 . (4.6)
. (4.6)
Жоғарыдағы (4.4) және (4.5) өрнектерінен келесі келесі өрнекті шығаруға болады:
 . (4.7)
. (4.7)
Бұдан идеал газдың бір молекуласының орташа кинетикалық энергиясы тек Т термодинамикалық температураға ғана тәуелді екенін көреміз:
 . (4.8)
. (4.8)
Соңғы өрнек идеал газ молекуласының термодинамикалық орташа кинетикалық энергиясы ( К) температураға пропорционал болатынын көрсетеді.
К) температураға пропорционал болатынын көрсетеді.
Энергияның еркіндік дәрежелер бойынша бірқалыпты таралу заңы
Дененің еркіндік дәрежесі (і) деп оның кеңістіктегі орнын толық анықтауға қажет тәуелсіз координаталардың ең аз санын айтады.
Идеал газдың қатаң байланысқан молекулалары үшін і мәні 4.1-кестеде берілген.
4.1–кесте
| Еркіндік дәрежесінің саны | Біратомды газ | Екіатомды газ | Көпатомды газ |
| Ілгерілемелі | |||
| Айналмалы | |||
| Барлығы |
Кестеден молекула үшін ілгерілемелі қозғалыстың еркіндік дәрежесі әрқашан үшке тең болатынын көреміз. Ілгерілемелі қозғалыстың әр еркіндік дәрежесіне бір атомды молекуланың орташа кинетикалық энергиясының үштен біріне (1/3) сәйкес келеді:
 . (4.9)
. (4.9)
Сондықтан, молекуланың еркіндік дәрежесі і болса, онда оның орташа кинетикалық энергиясы мына шамаға тең болады:
 . (4.10)
. (4.10)
Мөлшері 1 моль және массасы т кез-келген газдың ішкі энергиясы келесі өрнектермен анықталады:
 және
және  (4.11)
(4.11)
Сыртқы күш өрісіндегі бөлшектер үшін Больцман таралуы
Біртекті ауырлық күші өрісіндегі идеал газ қысымының биіктікке байланысты өзгеруі барометрлік формуламен анықталады:
 , (4.12)
, (4.12)
мұндағы: р мен р0 – газдың h және h = 0 биіктіктердегі қысымы, 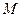 – газдың мольдік массасы. Осы өрнек пенкүй теңдеуі
– газдың мольдік массасы. Осы өрнек пенкүй теңдеуі  бойынша Больцман таралуы деп аталатын концентрацияның сыртқы потенциалдық өрісте биіктікке байланысты өзгеру заңын алуға болады:
бойынша Больцман таралуы деп аталатын концентрацияның сыртқы потенциалдық өрісте биіктікке байланысты өзгеру заңын алуға болады:
 немесе
немесе  , (4.13)
, (4.13)
мұндағы п мен п0 – газдың h және h = 0 биіктіктердегі концентрациясы, т0 – молекула массасы,  - бөлшектің потенциалдық энергиясы.
- бөлшектің потенциалдық энергиясы.
Барометрлік өрнек бойынша қысым арқылы (4.13) биіктікті анықтауға болады:
 . (4.14)
. (4.14)
Газ молекулаларының жылдамдықтар бойынша таралу заңы (Максвелл заңы)
Ықтималдылық теориясын қолдана отырып, 1860 жылы Максвелл идеал газ молекулаларының жылдамдықтар бойынша таралу заңын анықтады:

 (4.15)
(4.15)
мұндағы 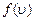 - таралу функциясы.
- таралу функциясы.
Функцияның нақты түрі газ тегіне (молекула массасы  ) және оның температурасына байланысты. Қысым мен көлем молекулалардың жылдамдықтар бойынша таралуына әсер етпейді. Таралу функциясы максимум болатын жылдамдық ең ықтимал жылдамдық
) және оның температурасына байланысты. Қысым мен көлем молекулалардың жылдамдықтар бойынша таралуына әсер етпейді. Таралу функциясы максимум болатын жылдамдық ең ықтимал жылдамдық  деп аталады.
деп аталады.
4.2 –сурет. Максвелл таралуы
 4.1– сурет. Таралу функциясының 4.1– сурет. Таралу функциясының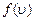 экстремумдары экстремумдары
| Таралу заңынан газдың берілген күйін сипаттайтын жылдамдықтарды анықтауға болады (7.2 – сурет; 7.2 – кесте). |
4.2 – кесте
Ең ықтимал жылдамдық 
| Орташа арифметикалық жылдамдық 
| Орташа квадраттық жылдамдық

|

| 
| 
|
Тасымалдау құбылыстары
Диффузия
Тасымалдау құбылыстарының теңдеулері мен тасымалдау коэффициенттері берілген 4.3– кестеде.
4.3– кесте
| Тасымалдау құбылыстары | Тасымалданушы шамалар | Тасымалдау теңдеуі | Тасымалдау коэффициенті |
| Диффузия | Масса | Фик заңы  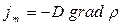
|

|
| Ішкі кедергі (тұтқырлық) | Импульс | Ньютон заңы  
|

|
| Жылуөткізгіштік | Жылу мөлшері (ішкі энергия) | Фурье заңы   = = 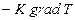
|

|
Тасымалдау коэффициенттері өзара келесі қатынастармен байланысқан:
 (4.16)
(4.16)
Тербелістер мен толқындар
Тербеліс деп белгілі уақыт бойынша қайталанып отыратын қозғалыстар мен процестерді айтады. Еркін тербелістер деп жүйенің өз энергиясы есебінен жүретін тербелістерді айтады. Еріксіз тербеліс тер деп сыртқы периодты күш әсерінен жүретін тербелістерді айтады.
Механикалық гармониялық тербелістер және олардың сипаттамалары
Материялық нүктенің тепе-теңдіктен ауытқуы уақыт бойынша синус немесе косинус заңына сәйкес өзгеретін болса, ондай тербелістерді гармониялық тербелістер деп атайды:
 , (4.17)
, (4.17)
мұндағы:  – тербеліс амплитудасы (нүктенің тепе-теңдіктен ең үлкен ауытқуы);
– тербеліс амплитудасы (нүктенің тепе-теңдіктен ең үлкен ауытқуы);  –
–  уақыттағы тербеліс фазасы;
уақыттағы тербеліс фазасы;  – циклдік жиілік;
– циклдік жиілік; 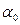 – бастапқы фаза,
– бастапқы фаза,  болғандағы тербеліс фазасы. Нүктенің жылдамдығы мен үдеуі де х сияқты
болғандағы тербеліс фазасы. Нүктенің жылдамдығы мен үдеуі де х сияқты  жиілікпен гармониялық тербеліс жасайды (6.1-сурет):
жиілікпен гармониялық тербеліс жасайды (6.1-сурет):
 6.1 – сурет. Гармониялық тербелістер. Орын ауыстыру,жылдамдық және үдеу графиктері.
6.1 – сурет. Гармониялық тербелістер. Орын ауыстыру,жылдамдық және үдеу графиктері.
|  , (4.18) , (4.18)  . (4.19)
Олардың амплитудалары сәйкесінше . (4.19)
Олардың амплитудалары сәйкесінше  және және 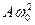 . Жылдамдық фазасы ығысу фазасынан . Жылдамдық фазасы ығысу фазасынан  алда, ал үдеу мен ығысу қарама-қарсы фазада болады. Механикалық гармониялық тербелістердің дифференциалдық теңдеуін (6.3) түрлендіру арқылы анықтауға болады: алда, ал үдеу мен ығысу қарама-қарсы фазада болады. Механикалық гармониялық тербелістердің дифференциалдық теңдеуін (6.3) түрлендіру арқылы анықтауға болады:
 . (4.20) . (4.20)
|
Гармониялық тербелістегі материялық нүкте энергиясы Массасы 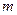 материялық нүкте тепе-теңдіктен х шамаға ауытқығанда,оған
материялық нүкте тепе-теңдіктен х шамаға ауытқығанда,оған  шамасына пропорционал, ауытқу бағытына кері бағытталған Ғ күш әсер етеді:
шамасына пропорционал, ауытқу бағытына кері бағытталған Ғ күш әсер етеді:
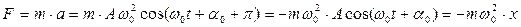 . (4.21)
. (4.21)
Бұл квазисерпімді күш – консервативтік күш. Сондықтан, гармониялық тербеліс кезінде кинетикалық энергия  мен потенциалдық энергия
мен потенциалдық энергия  бір-біріне түрленіп отырады, ал жүйенің толық энергиясы тұрақты болады.
бір-біріне түрленіп отырады, ал жүйенің толық энергиясы тұрақты болады.
Түзу сызықты гармониялық тербеліс жасап тұрған материялық нүктенің кинетикалық, потенциалдық және толық энергиялары келесі формулалармен анықталады:
 ; (4.22)
; (4.22)
 ; (4/23)
; (4/23)
 . (4.24)
. (4.24)
Өшпелі тербелістер
Өшпелі тербелістер деп уақыт өткен сайын біртіндеп әлсірей беретін тербелістерді айтады. Жүйенің тербеліс энергиясы негізінен үйкеліске (диссипацияға) байланысты азаяды. Тұтқыр ортада тербелістегі денеге серпімділік (немесе квазисерпімді) күшінен басқа қозғалыс жылдамдығына пропорционал  үйкеліс күші де әсер етеді, мұндағы
үйкеліс күші де әсер етеді, мұндағы  – үйкеліс коэффициенті,
– үйкеліс коэффициенті,  –жылдамдық. Минус таңбасы
–жылдамдық. Минус таңбасы  мен
мен  векторларының бағыттары қарама-қарсы болатынын көрсетеді.
векторларының бағыттары қарама-қарсы болатынын көрсетеді.
Еркін өшетін тербелістердің дифференциалдық теңдеуі:  , немесе
, немесе  , немесе:
, немесе:
 . (4/25)
. (4/25)
Мұндағы:  – осы жүйенің еркін тербелісінің ( – осы жүйенің еркін тербелісінің ( ) циклдік жиілігі, ) циклдік жиілігі,  – үйкеліс коэффициенті. (6.16) теңдеудің тербелістің өшуі баяу ( – үйкеліс коэффициенті. (6.16) теңдеудің тербелістің өшуі баяу ( ) болғандағы шешуі: ) болғандағы шешуі:
 . (6.17)
Суретте бұл функцияның графигі тұтас сызықпен көрсетілген. . (6.17)
Суретте бұл функцияның графигі тұтас сызықпен көрсетілген.
|  Өшпелі тербеліс
Өшпелі тербеліс
|
Тербеліс амплитудасы ( ) уақыт бойынша экспонента заңымен кемиді (6.5 – суретте үзік-үзік сызықтармен келтірілген).
) уақыт бойынша экспонента заңымен кемиді (6.5 – суретте үзік-үзік сызықтармен келтірілген).
Амплитуданың е есе кемуіне кеткенуақыт релаксация уақыты деп аталады:  . Өшпелі тербелістің периоды келесіөрнекпен анықталады:
. Өшпелі тербелістің периоды келесіөрнекпен анықталады:
 . (4.26)
. (4.26)
Мұндағы:  – өшпелі тербелістің циклдік жиілігі.
– өшпелі тербелістің циклдік жиілігі.
Еріксіз тербелістер
Сыртқы периодты күштер әсерінен жүретін тербеліс еріксіз тербеліс деп аталады. Механикалық тербелмелі жүйеге әсер ететін сыртқы гармоникалық күш:  :
:
 немесе
немесе  , (4.27)
, (4.27)
мұндағы:  – еркін өшпейтін тербелістіңциклдік жиілігі;
– еркін өшпейтін тербелістіңциклдік жиілігі;  – өшу коэффициенті;
– өшу коэффициенті;  .
.
Жоғарыдағы теңдеудің дербес шешуі  түрінде болады. Мұндағы
түрінде болады. Мұндағы  амплитуда мен
амплитуда мен  бастапқы фаза келесі формулалармен анықталады:
бастапқы фаза келесі формулалармен анықталады:
 және
және  . (4.28)
. (4.28)
Өзін-өзі бақылауға арналған тесттер:
1. Көлемі V0  колбадағы газ қысымын p 0 = 760 мм бағ – нан p = 0,10 мм сын бағ – на дейін төмендету үшін ротациялық майлы сорап газды қанша уақыт соруы керек? Қысымның көрсетілген аралығы үшін сораптың әсер ету шапшаңдығы К =180 см3/с. Колбадағы газ температурасының сору кезіндегі өзгерісін ескермеуге болады.
колбадағы газ қысымын p 0 = 760 мм бағ – нан p = 0,10 мм сын бағ – на дейін төмендету үшін ротациялық майлы сорап газды қанша уақыт соруы керек? Қысымның көрсетілген аралығы үшін сораптың әсер ету шапшаңдығы К =180 см3/с. Колбадағы газ температурасының сору кезіндегі өзгерісін ескермеуге болады.
A) 30 с
B) 45 с
C) 54 с
D) 74 с
E) 65 с
2. Азот пен сутегі қоспасының t = 470 C температура мен p = 2,00 ат қысымдағы тығыздығы 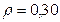 г/л. Қоспадағы азот және сутегі молекулаларының концентрациясын табу керек.
г/л. Қоспадағы азот және сутегі молекулаларының концентрациясын табу керек.
A) 2,4∙ 1024 м-3; 4,2∙ 1025 м-3
B) 6,4∙ 1024 м-3; 5,2∙ 1025 м-3
C) 3,4∙ 1024 м-3; 4,2∙ 1025 м-3
D) 8,4∙ 1024 м-3; 7,2∙ 1025 м-3
E)5,4∙ 1024 м-3; 4,2∙ 1025 м-3
3. Теңіз деңгейінен h = 2 км биіктікте орналасқан ауаның көлем бірлігіндегі п молекулалар санын анықтау керек. Температура тұрақты және 10  C. Теңіз деңгейіндегі қысым р0 = 101 кПа.
C. Теңіз деңгейіндегі қысым р0 = 101 кПа.
A) 3,0 ∙ 10 25 м-3
B) 4,0 ∙ 10 25 м-3
C) 2,0 ∙ 10 25 м-3
D) 2,0 ∙ 10 35 м -3
E)5,0 ∙ 10 25 м-3
4. t = 20º C температура кезінде судың тығыздығы судың қаныққан буының осы температурадағы тығыздығынан неше есе (N) үлкен? Осы температурадағы судың қаныққан буының қысымы р = 2,33 кПа.
A) N = 2,9∙ 104 есе
B) N = 4,9∙ 104 есе
C) N = 3,9∙ 104 есе
D) N = 6,9∙ 104 есе
E)N = 5,9∙ 104 есе
5. t = 0º C температурада 1м  көлемдегі қаныққан су буы молекулаларының санын (n) табу керек. Берілген температурада судың қаныққан буының қысымы р = 0,61 кПа.
көлемдегі қаныққан су буы молекулаларының санын (n) табу керек. Берілген температурада судың қаныққан буының қысымы р = 0,61 кПа.
A) 
B) 
C) 
D) 
E) 
5-дәріс
Термодинамиканың бірінші бастамасы. Заттың жылусыйымдылығы. Изопроцестер. Жүйенің ішкі энергиясы. Жұмыс және жылу. Идеал газ изопроцестерінде термодинамиканың бірінші бастамасын қолдану. Термодинамиканың екінші бастамасы. Карно теоремасы. Клаузиус теоремасы. Энтропия. Қайтымды және қайтымсыз процестер. Тұйық процестер.Нақты газдар. Ван-дер-Ваальс теңдеуі.Нақты газдың ішкі энергиясы.
Термодинамикның бірінші бастамасы
Термодинамикада макраскопиялық денелердің жылулық қасиеттері олардың микроскопиялық табиғатымен байланыстырмай,тәжірибе арқылы анықталған үш заңға (бастамаларға) сүйеніп зерттеледі. Термодинамиканың бірінші бастамасы энергияның сақталу және түрлену заңдарын сипаттайды.
Жүйенің ішкі энергиясы
Ішкі энергия жүйедегі барлық микробөлшектердің – атомдар мен молекулалардың қозғалыс энергияларынан және олардың өзара әсерлесу энергияларынан құралады.  өрнегіненен идеал газдың ішкі энергиясы тек температураға тәуелді екендігін.
өрнегіненен идеал газдың ішкі энергиясы тек температураға тәуелді екендігін.
Жұмыс және жылу
Тепе-теңдік процесс кезінде газдың көлемі өзгергенде жасалатын элементар жұмыс
 (5.1)
(5.1)
болады.
Газдың қысымы әрқашан оң (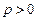 ). Сондықтан, ұлғаю кезінде (
). Сондықтан, ұлғаю кезінде ( ) газ оң жұмыс жасайды (
) газ оң жұмыс жасайды ( ), ал сығылу кезінде (
), ал сығылу кезінде ( ) газ теріс жұмыс жасайды (
) газ теріс жұмыс жасайды ( ).
).
Сыртқы денелерден жүйеге энергияның жылуалмасу арқылы берілуі жылу деп аталады. Жылуалмасу әртүрлі температурадағы денелер арасында немесе бір дененің бөлшектері арасында жүреді.
Дененің жылу немесе жұмыс қоры деген түсінік жоқ. Сондықтан  мен
мен  күй функциясы емес, процесс функциясы.
күй функциясы емес, процесс функциясы.
Термодинамиканың бірінші заңы
Жүйеге берілген жылу мөлшері оның ішкі энергиясының өзгерісі мен жүйенің сыртқы күштерге қарсы жасайтын жұмысына жұмсалады:
 . (5.2)
. (5.2)
Бұл термодинамикалық жүйе үшін энергияның сақталу және түрлену заңы. Жылу энергиясы тек ішкі энергия мен жұмысқа ғана түрленуі мүмкін: ішкі энергия – энергияның микроскопиялық, ал жұмыс – макроскопиялық түрі.
Жүйеге берілген жылудың  аз мөлшерінің жүйе жасайтын
аз мөлшерінің жүйе жасайтын  элементар жұмыс пен
элементар жұмыс пен  ішкі энергияның аз өзгерісіне жұмсалатынын сипаттайтын бұл заңды әдетте мына түрде жазады:
ішкі энергияның аз өзгерісіне жұмсалатынын сипаттайтын бұл заңды әдетте мына түрде жазады:
 . (5.3)
. (5.3)
Жылу  мен жұмыс
мен жұмыс  және ішкі энергия өзгерісі
және ішкі энергия өзгерісі  жазылулары арасындағы өзгешеліктің, жоғарыда айтылғандай, терең физикалық мағынасы бар.
жазылулары арасындағы өзгешеліктің, жоғарыда айтылғандай, терең физикалық мағынасы бар.
Заттың жылусыйымдылығы
Заттың жылулық қасиеттерін сипаттайтын негізгі параметрлердің бірі оның жылусыйымдылығы. Заттың жылусыйымдылығы  – дененің температурасын 1K-ге өзгертуге қажет
– дененің температурасын 1K-ге өзгертуге қажет  жылу мөлшеріне тең физикалық шама:
жылу мөлшеріне тең физикалық шама:
 . (5.4)
. (5.4)
Заттың жылусыйымдылығы оның массасына, химиялық құрамына, термодинамикалық күйіне және оған  жылу беру процесіне тәуелді. Жылусыйымдылық меншікті(
жылу беру процесіне тәуелді. Жылусыйымдылық меншікті(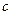 ) (бірлік массаның жылусыйымдылығы) және мольдік (
) (бірлік массаның жылусыйымдылығы) және мольдік ( ) (1 моль заттың жылусыйымдылығы) болып ажыратылады:
) (1 моль заттың жылусыйымдылығы) болып ажыратылады:
 және
және 
 , (5.5)
, (5.5)
мұндағы:  – зат мөлшері;
– зат мөлшері;  – затың мольдік массасы.
– затың мольдік массасы.

 (5.6)
(5.6)
Термодинамиканың бірінші бастамасын идеалгаздардағы изопроцестерге қолдану.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 1319; Нарушение авторских прав?; Мы поможем в написании вашей работы!