
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фазовые переходы в веществе. Диаграмма состояний
|
|
|
|
Как в жидкостях, так и в твердых телах имеются молекулы, энергия которых достаточна, чтобы преодолеть силы притяжения других молекул, и перейти в окружающее пространство от поверхности жидкого или твердого веществ. Этот процесс для жидкости называется испарением, а для твердых тел сублимацией.
Фазой называется термодинамически равновесное состояние вещества, отличающееся от других возможных равновесных состояний того же вещества, по физическим свойствам.
Переход вещества из одной фазы в другую, фазовый переход, связан с качественным изменением свойств вещества.
Фазовый переход первого рода сопровождается поглощением или выделением теплоты (например: плавление, кристаллизация). Для них характерны:  . (изменения энтропии и объема).
. (изменения энтропии и объема).
Фазовые переходы второго рода не связаны с выделением, поглощением теплоты или изменением объема. Они характеризуются:  , но скачкообразным изменением теплоемкости.
, но скачкообразным изменением теплоемкости.
Для популярного изображения фазовых превращений используется диаграмма состояний, на которой в координатах 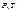 задается зависимость между температурой фазового перехода и давлением в виде кривых испарения (КИ), плавления (КП) и сублимации (КС). Они разделяют поле диаграммы на три области, соответствующие условиям существования вещества в твердой (Т), жидкой (Ж), и газообразной (Г) фазах. Кривые на диаграмме называются кривыми фазового равновесия; каждая точка на них соответствует условиям равновесия двух соответствующих фаз; КП – твердого тела и жидкости, КИ – жидкости и газа, КС – твердого тела и газа.
задается зависимость между температурой фазового перехода и давлением в виде кривых испарения (КИ), плавления (КП) и сублимации (КС). Они разделяют поле диаграммы на три области, соответствующие условиям существования вещества в твердой (Т), жидкой (Ж), и газообразной (Г) фазах. Кривые на диаграмме называются кривыми фазового равновесия; каждая точка на них соответствует условиям равновесия двух соответствующих фаз; КП – твердого тела и жидкости, КИ – жидкости и газа, КС – твердого тела и газа.
Точка, в которой пересекаются эти кривые, и которая, следовательно, определяет условия (температуру 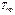 и соответствующее ей равновесное давление
и соответствующее ей равновесное давление  ) одновременного равновесного сосуществования трех фаз вещества, называется тройной точкой. Каждое вещество имеет одну тройную точку. Для воды эта точка соответствует температуре 273, 16 0К (или температуре 0,010 по шкале Цельсия),
) одновременного равновесного сосуществования трех фаз вещества, называется тройной точкой. Каждое вещество имеет одну тройную точку. Для воды эта точка соответствует температуре 273, 16 0К (или температуре 0,010 по шкале Цельсия),  609 Па.
609 Па.
36. кристаллическое строение твёрдых тел.
Твердые тела (кристаллы) характеризуются наличием значительных сил межмолекулярного взаимодействия, и сохраняют объем и форму.
Структура, для которой характерно регулярное расположение частиц с периодической повторяемостью в трех измерениях, называется кристаллической решеткой.
Точки, в которых расположены частицы или, точнее, средние равновесные положения, около которых частицы совершают колебания, называются узлами кристаллической решетки.
Кристаллические тела делятся на две группы: монокристаллы и поликристаллы.
Монокристаллы – твердые тела, частицы которых образуют единую кристаллическую решетку. Кристаллическая структура кристаллов обнаруживается по их внешней форме. Углы между соответствующими гранями остаются постоянными. Монокристаллами является большинство минералов (лед, поваренная соль, исландский шпат).
Большинство твердых тел, имеющих мелкокристаллическую структуру, называются поликристаллами (многие горные породы, металлы, сплавы).
Характерной особенностью монокристаллов является их анизотропность, т.е. зависимость физических свойств – упругих, тепловых и т.д. от направления. Поликристаллы – изотропны. В поликристаллах анизотропия наблюдается только для отдельных мелких кристалликов (зерен).
Существует два типа признаков для классификации кристаллов:
· кристаллографический,
· физический.
В первом случае, (кристаллографический признак кристалла) кристаллическая решетка обладает симметрией. Симметрия кристаллической решетки - ее свойство совмещаться с собой при некоторых пространственных перемещениях.
Всякая кристаллическая решетка может быть составлена повторением в разных направлениях структурного элемента – элементарной ячейки. Она представляет собой параллелепипед, построенный на ребрах 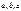 с углами
с углами 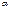 ,
,  ,
,  между ребрами. Эти величины называются параметрами элементарной ячейки.
между ребрами. Эти величины называются параметрами элементарной ячейки.
Во втором случае (физический признак кристаллов) – в зависимости от рода частиц в узлах решетки и характера сил взаимодействия между ними кристаллы делятся на: ионные, атомные, металлические, молекулярные.
В ионных кристаллах в узлах кристаллической решетки находятся ионы противоположного знака. Например:  (оксиды металлов). Силы взаимодействия между ионами, в основном, электростатические. Связь, обусловленная кулоновскими силами между противоположно заряженными ионами, - ионная или гетерополярная.
(оксиды металлов). Силы взаимодействия между ионами, в основном, электростатические. Связь, обусловленная кулоновскими силами между противоположно заряженными ионами, - ионная или гетерополярная.
В атомных кристаллах в узлах кристаллической решетки расположены нейтральные атомы, удерживающиеся ковалентными связями квантово – механического происхождения. Примеры атомных кристаллов: алмаз и графит,  и т.д. Ковалентные связи осуществляются парами электронов, движущимися по орбитам, охватывающим оба атома.
и т.д. Ковалентные связи осуществляются парами электронов, движущимися по орбитам, охватывающим оба атома.
В узлах кристаллической решетки металлических кристаллов располагаются положительные ионы металла. Между ними движутся свободные электроны, наличие которых обеспечивает хорошую электропроводность металлов. Примерами являются:  , т. е. все металлы.
, т. е. все металлы.
В молекулярных кристаллах в узлах кристаллической решетки располагаются нейтральные молекулы вещества, силы взаимодействия между которыми обусловлены взаимным смещением электронов в электронных оболочках атомов. Молекулярными кристаллами является ряд соединений (парафин, спирт, лед).
Отклонения от упорядоченного расположения частиц в узлах решетки называются дефектами кристаллической решетки.
Наличие дефектов в кристаллической решетке влияет на свойства кристаллов.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 891; Нарушение авторских прав?; Мы поможем в написании вашей работы!