
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислотно-основні індикатори
|
|
|
|
Індикатори
Теоретичні відомості
План проведення заняття
Уміти
Знати
Навчальна мета
Матеріальне забезпечення
ІНДИКАТОРИ
Універсальні системи
Фосфатні системи
Буферні розчини для визначення рН
АЛГОРИТМ № 23
| рН | 0,2М Nа2НР04, мл | 0,1 М лимонна кислота, мл | pН | 0,2 М Nа2НРО4, мл | О,1 М лимонна кислота, мл |
| 2,4 | 1,24 | 18,76 | 5,6 | 11,60 | 8,40 |
| 3,0 | 4,11 | 15,89 | 6,0 | 12,63 | 7,37 |
| 3,4 | 5,70 | 14,30 | 6,4 | 13,85 | 6,15 |
| 4,0 | 7,71 | 12,29 | 7,0 | 16,47 | 3,53 |
| 4,6 | 9,35 | 10,65 | 7,6 | 18,73 | 1,27 |
| 5,0 | 10,30 | 9,70 | 8,0 | 19,45 | 0,55 |
До 100 мл системи однакових об'ємів 0,04 М Н3РО4, 0,04 М СН3СООН і 0,04 М Н3ВО3 додають х мл 0,2 н. розчину NаОН
| РН | x | рН | x | РН | x |
| 2,09 | 7,5 | 6,09 | 42,5 | 9,62 | 75,0 |
| 2,56 | 15,0 | 6,59 | 47,5 | 9,91 | 77,5 |
| 3,29 | 20,0 | 7,00 | 52,5 | 10,38 | 80,0 |
| 4,1 | 25,0 | 7,54 | 57,5 | 11,20 | 85,0 |
| 4,56 | 30,0 | 7,96 | 60,0 | 11,58 | 90,0 |
| 5,02 | 35,0 | 8,69 | 65,0 | 11,98 | 100,0 |
| 5,33 | 37,5 | 9,15 | 70,0 |
Питання для самоконтролю
1. Які розчини називають буферними?
2. Наведіть приклади буферних сумішей.
3. Як впливає на величину рН буферної суміші, що складається з оцтової кислоти та її натрієвої солі, невелика кількість сильної кислоти?
4. Як впливає на величину рН буферної суміші, що складається з гідроксиду амонію та хлориду амонію, невелика кількість лугу?
5. Чому розведення водою буферної суміші не змінює рН розчину?
6. Наведіть приклади застосування буферних сумішей.
7. Поясніть механізм дії і види буферних розчинів.
8. Поясніть, чому додавання невеликої кількості розчину гідроксиду натрію в буферний розчин (Nа2В4О7 + Н3ВО3) не змінює рН середовища.
9. Поясніть, чому розведення в 100 разів буферної суміші, що складається з NН4ОН і NH4С1, не змінює рН середовища.
Індикатори: метилоранж, метиловий червоний, лакмус, фенолфталеїн.
1. Види індикаторів.
2. Характеристику індикаторів.
1. Приготувати розчини індикаторів (метилового оранжевого, метилового червоного, фенолфталеїну).
1. Індикатори, їх характеристика.
2. Приготування розчинів індикаторів:
а) метилового оранжевого;
б) метилового червоного;
в) фенолфталеїну.
Індикатори — хімічні речовини, за якими при титриметричних методах аналізу можна виявити, що до титрованого розчину додано еквівалентну кількість титранту. Зміни, які відбуваються з індикаторами в точці еквівалентності, визначають візуальним або інструментальним методом.
Залежно від реакцій, на яких ґрунтуються титриметричні методи, індикатори бувають: кислотно-основні для водних і неводних середовищ, металохромні (в комплексонометрії), адсорбційні (осадоутворювальні) і окисно-відновні. Розчини та індикаторні суміші готують з тонкорозтертих індикаторів і допоміжних речовин кваліфікації "хімічно чистий" або "чистий для аналізу". Наважку індикатору беруть з точністю 0,001 г і розчиняють у мірній колбі (розчин індикатору) або розтирають і перемішують у ступці з допоміжною речовиною (індикаторною сумішшю).
Для приготування розчинів індикаторів у розчині натру їдкого (0,02 моль/л) наважку індикатору розтирають у ступці з розчином лугу до розчинення. Отриманий розчин переносять у мірну колбу. З водорозчинних індикаторів готують 0,04 % водні розчини. Кількість індикатору, яку треба додати, повинна бути вказана. Розчини та індикатори суміші готують у витяжній шафі з використанням індивідуальних засобів захисту (респіраторів, захисних окулярів, гумових рукавичок).
Індикатори, індикаторні суміші та розчини індикаторів зберігають у захищеному від світла місці. Індикаторні суміші та розчини змішаних індикаторів зберігають у банках або флаконах оранжевого кольору (табл. 1).
Механізм дії індикаторів. Кислотно-основні індикатори змінюють свій колір при зміні рН середовища внаслідок зміни концентрації йонів гідрогену. Індикатори існують в дисоційованій і неди-соційованій формах, які відрізняються забарвленням. Форми індикатору в розчині знаходяться в рівновазі, яка описується константою:
 Hind H+ + Ind-;
Hind H+ + Ind-;
K =  ; 50
; 50
pK = pH + lg 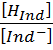 ;
;
При зміні концентрації йонів гідрогену Н+ відбуваються зсуви рівноваги, які призводять до збільшення концентрації однієї з форм і зменшення іншої. При цьому змінюється забарвлення розчину. Наприклад, фенолфталеїн при [Н+] > 10 -9 (рН < 9) існує в основному в безбарвне недисоційованій формі, в лужному середовищі (рН >9) — в дисоційованій формі червоно-малинового забарвлення. Забарвлення індикатору змінюється в деякому інтервалі змін рН середовища, який називають інтервалом переходу індикатору з однієї форми в іншу. Кожен індикатор має свій інтервал переходу, який залежить від особливостей структури індикатору.
Показник титрування. Індикатори характеризують показником титрування рТ, який являє собою величину рН середини інтервалу переходу, коли [НІnd] = [Іnd-]. При цьому:
pT = pK = pH + lg  = pH.
= pH.
Наприклад, метиловий оранжевий змінює забарвлення від червоного до жовтого в інтервалі рН 3,1—4,4 і має показник титрування рТ 4,0. При рН 4 половина його молекул знаходиться в недисоційованій, половина — в дисоційованій формі. Вважають, що при рН = рТ титрування закінчується.
Забарвлення розчину залежить від його концентрації. Чим більша концентрація індикатору, тим інтенсивніше забарвлення розчину. Щоб уникнути неточностей, рекомендується до титрованого розчину завжди додавати відповідну кількість розчину індикатору (1—2 краплі).
Метиловий оранжевий (натрієва сіль 4-диметиламіноазобензол-4'-сульфакислоти). Порошок жовто-оранжевого кольору, який утворює жовті розчини в лужному середовищі. У кислому середовищі індикатор змінює забарвлення до червоного внаслідок утворення хіноїдної сполуки.
Інтервал переходу забарвлення в межах рН 3,1 — 4,4, рТ 4. Використовують 0,1% водний розчин метилового оранжевого. 0,05 г барвника розчиняють в 100 мл води, індикатор застосовують у кількості 1—4 краплі.
Метиловий червоний (М-диметиламіноазобензол-2-карбонова кислота). Подібна до будови метилового оранжевого. Порошок червоно-бурого кольору. В лужному середовищі знаходиться у вигляді жовтої азоформи, а в кислому переходить у червону хіноїдну форму. Інтервал переходу — в інтервалі змін рН 4,2—6,2, рТ 5. Використовують у вигляді 0,2 % розчину в 60 % етанолі. 0,2 г барвника розчиняють у 100 мл суміші, яка складається із 60 мл етилового спирту і 40 мл води. Індикатор застосовують у кількості 1— З краплі.
Лакмус. 1 г барвника розчиняють у 100 мл води. Застосовують 2—10 крапель.
Фенолфталеїн. 4,4-диоксифталофенол, порошок білого кольору. Водні розчини в кислому середовищі безбарвні, в лужному — червоно-малинового кольору внаслідок утворення хіноїдного угруповання.
Інтервал переходу при рН 8,0—10,0, рТ 9,0. Використовують у вигляді 0,1 % розчину в 50 % етанолі. У лужному середовищі (рН > 12) фенолфталеїн знебарвлюється.
0,1г барвника розчиняють у суміші спирту і води (70 мл етанолу і ЗО мл води).
Таблиця 1. Характеристика індикаторів
| Назва індикатору | . Забарвлення індикатору | Інтервал індикатора в рН | |
| Кислотна форма | Лужна форма | ||
| Метилоранж | Червона | Жовта | З,1-4,4 |
| Метил червоний | Червона | Жовта | 4,2-6,2 |
| Лакмус | Червона | Синя | 5,0—8,0 |
| Фенолфталеїн | Безбарвна | Червоно-фіолетова | 8,0—9,8 |
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 147; Нарушение авторских прав?; Мы поможем в написании вашей работы!