
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Класифікація кислотно-основних буферних систем
|
|
|
|
Буферні розчини
Теоретичні відомості
План проведення заняття
Уміти
Знати
Навчальна мета
Матеріальне забезпечення
Буферні розчини: фосфатний, ацетатний, аміачний.
1. Класифікацію буферних систем.
2. Роль буферних розчинів у людському організмі.
1. Визначати рН буферних розчинів.
1. Класифікація кислотно-основних буферних систем.
2. Визначення рН буферних розчинів.
3. Значення буферних систем.
У хімії, біології, медицині, промисловому виробництві ті чи інші процеси дуже часто відбуваються при постійних значеннях рН, а під час реакцій йони гідрогену можуть вбиратися або виділятися. Щоб процес відбувався при сталому значенні рН, у розчин уводять буферні суміші, які вбирають йони гідрогену або гідроксид-йони, і значення рН розчину практично не змінюється.
Буферними розчинами називають розчини суміші слабкої кислоти (або слабкої основи) та її солі, наприклад суміш (СН3СООН + СН3СО(Nа), суміш гідроксиду амонію і хлориду амонію (NH4ОН + NH4С1).
Буферні системи можуть бути чотирьох типів.
1. Слабка кислота та її аніон. Наприклад, ацетатна буферна система СН3СОО7/СН3СООН у розчині СН3СООNа і СН3СООН, діапазон дії — рН 3,8 — 5,8. Гідрогенкарбонатна система НСО3-/Н2СО3 в розчині NаНСО3 і Н2СО3, діапазон дії — рН 5,4 — 7,4.
2. Слабка основа і її катіон. (В/ВН+). Наприклад, аміачна буферна система NН3/NН4+ у розчині NН3і NН4С1, діапазон її дії — рН 8,2 —10,2.
3. Аніони кислої і середньої солі або кислих солей. Наприклад, фосфатна буферна система НРО  / Н2Р04 у розчині Nа2НРО4 і NаН2РО4, діапазон їх дії рН — 6,2 — 8,2.
/ Н2Р04 у розчині Nа2НРО4 і NаН2РО4, діапазон їх дії рН — 6,2 — 8,2.
4. Йони і молекули амфолітів. До них належать амінокислоти і білкові буферні системи. Якщо амінокислоти і білки перебувають в ізоелектричному стані (сумарний заряд молекул рівний нулю), то розчини цих сполук не є буферними. Вони проявляють буферну дію, коли до них додавати деяку кількість кислоти або лугу. Тоді частина білка (амінокислоти) переходить із ізоелектронного стану в форму білок—амінокислота або відповідає формулі білок—основа. При цьому виникає система двох форм білка: а) слабка білок— кислота + сіль цієї слабкої кислоти; б) слабка білок—основа + сіль цієї слабкої основи. 45
Механізм буферної дії можна розглянути на прикладі ацетатної буферної системи СН3СОО~/СН3СООН, в основі дії якої лежить кислотно-основна рівновага:
 СН.СООН СН3СОО- + Н+; рКа = 4,8.
СН.СООН СН3СОО- + Н+; рКа = 4,8.
Основне джерело ацетат-йонів — сильний електроліт ацетат СН3СООNа — при додаванні сильної кислоти поєднана основа СН3СОО- зв'язує додаткові йони Н+, перетворюючись на слабку оцтову кислоту:
сн3соо- + н+о сн„соон.
Кислотно-основна рівновага зміщується ліворуч за принципом Ле Шательє.
Зменшення концентрації аніонів СН3СОО- точно зрівноважується підвищенням концентрації молекул СН3СООН. У результаті відбувається невелика зміна в співвідношенні концентрацій слабкої кислоти та її солі, а значить і ненабагато змінюється рН.
При додаванні лугу протони оцтової кислоти (резервна кислотність) вивільняються і нейтралізують додаткові йони ОН-, зв'язуючи їх у молекули води:
 сн3соон + он- сн3соо- + н,о
сн3соон + он- сн3соо- + н,о
Кислотно-основна рівновага зміщується праворуч за принципом Ле Шательє.
У цьому випадку відбувається невелика зміна в співвідношенні концентрації слабкої кислоти та її солі, а значить, і незначна зміна рН. Зменшення концентрацій слабкої кислоти СН3СООН точно зрівноважується підвищенням концентрації аніонів СН3СОО-.
При додаванні до цих сумішей сильної кислоти або сильної основи відбуваються такі реакції:
 СНСООNа + НС1 СН3СООН + NаСІ;
СНСООNа + НС1 СН3СООН + NаСІ;
 СН3СООН + NаОН СН3СООNа + Н2О;
СН3СООН + NаОН СН3СООNа + Н2О;
 NH4OH + HCl NН4С1 + Н2О;
NH4OH + HCl NН4С1 + Н2О;
 NН4С1 + NaОН NaCl + NH4OH.
NН4С1 + NaОН NaCl + NH4OH.
Отже, при дії на буферний розчин сильної кислоти або сильної основи змінюється концентрація слабкої кислоти (або слабкої основи). Проте рН розчину практично не змінюється. Це пояснюється тим, що слабка кислота (або слабка основа) мало дисоціює, а за наявності однойменних йонів її солі дисоціація відбувається ще меншою мірою. Таким чином, рН буферної суміші під впливом сильної основи або сильної кислоти практично не змінюється.
Не змінюється рН буферної суміші і при розведенні, тому що залежить лише від співвідношення концентрації солі та кислоти. Це видно з формули, яку використовують для обчислення рН буферної суміші:
рН = рК к-ти + lg 
де рК к-ти = lgК к-ти.
Для буферної суміші, що складається із слабкої основи та її солі, формула для обчислення рОН така:
рОН = рК основи + lg 
де рК основи = lgК основи.
Буферні розчини часто використовують у хімічній промисловості в якісному та кількісному аналізах, коли потрібно виконати реакцію при певному значенні рН.
Коли за допомогою дихромату калію виявляють йони барію в оцтовокислому середовищі за наявності йонів стронцію, відбувається така реакція: 46
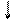
 2Ва2+ + СrO27- + Н2О 2Ва СrO4 + 2H+.
2Ва2+ + СrO27- + Н2О 2Ва СrO4 + 2H+.
У результаті реакції утворюється жовтий осад хромату барію, який розчиняється в кислоті. Ось чому виділення йонів гідрогену під час реакції — явище небажане. Щоб реакція відбувалася до кінця, розчин потрібно нейтралізувати. Використовувати для цього розчин лугу не можна, оскільки в лужному середовищі осаджуватиметься хромат стронцію. Тому йони гідрогену, що виділяються в результаті реакції, зв'язують додаванням розчину ацетату натрію. Утворюється буферна суміш, у якій рН близько 5. При цьому значенні рН стронцій залишається в розчині, йони барію повністю осаджуються.
Буферні суміші використовують у кількісному аналізі при титруванні слабких основ і слабких кислот. У цьому разі наприкінці титрування утворюються солі слабких кислот або основ і трохи вільної кислоти або основи. Тому щоб правильно вибрати індикатор, потрібно враховувати утворення буферної суміші і, виходячи з цього, обчислювати рН у точці еквівалентності.
У хімічному аналізі використовують такі буферні суміші: борної кислоти і борату натрію, одно- і двозаміщених фосфатів калію, винної кислоти та її солі, лимонної кислоти та її солі тощо.
Кожний буферний розчин має певну буферну ємність — здатність розчину зберігати сталу величину рН при додаванні кислот або лугів. Вона визначається кількістю еквівалентних мас кислоти (або лугу), яку треба додати, щоб величина рН 1 л буферного розчину змінилася на одиницю.
Буферні розчини широко застосовуються в аналітичній хімії. В якісному аналізі багато процесів осадження малорозчинних електролітів проходять при певному значенні рН розчину. Осадження йонів кальцію у вигляді солі СаКNH4[Fе(СN)3] відбувається при певному значенні рН. З цією метою додають буферну суміш NН4С1. Щоб виявити йони магнію за допомогою моногідрофосфату натрію, застосовують буферну суміш (NH4(ОН) + NН4С1). Вона створює рН 8,5, при якому гідроксид магнію не осаджується, айонмагнію виділяється у вигляді солі МgNН4РО4.
Буферні розчини широко застосовуються і в кількісному аналізі. Гравіметричне визначення багатьох йонів (А13+, Мg2+ та ін.) відбувається за певного значення рН розчину, яке створюється за допомогою тієї чи іншої буферної суміші. Титриметричне визначення багатьох металів трилоном Б проходить при певному значенні рН (8—10). Необхідне середовище створюється додаванням до розчину амонійної буферної суміші (NН4(ОН) + NH4С1).
Буферні розчини відіграють важливу роль у житті організму, забезпечуючи стале рН його внутрішнього середовища. Наприклад, у крові людини наявні 3 види буферних систем: фосфатна, гідро-карбонатна, білкова.
Якщо в крові якимось чином створюється надлишок йонів Н+, то він зв'язується з одним із компонентів тієї чи іншої буферної системи. Завдяки цьому в організмі людини сталим є рН не тільки крові (7,36—7,40), а й слини (7,0), жовчі (8,0) тощо. Зміна рН крові й жовчі може відбутися при різних захворюваннях. Наприклад, у тяжких випадках цукрового діабету рН крові зміщується в кислу сторону (ацидоз), а при тяжкій нирковій або печінковій недостатності може зміститися рН крові в лужний бік (алкалоз).
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 130; Нарушение авторских прав?; Мы поможем в написании вашей работы!