
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
При работе такого электрода в нем протекает процесс
|
|
|
|
При постоянной концентрации соли в растворе потенциал электрода второго рода не изменяется и может быть рассчитан с высокой точностью. Это свойство позволило использовать различные электроды данного типа в качестве стандарта при измерении потенциалов вместо водородного электрода.
Наибольшее применение в лабораторной практике нашли хлорсеребряный и каломельный электроды. Хлорсеребряный электрод изготавливается из серебряной проволоки, покрытой слоем хлорида серебра и смачиваемой раствором хлорида калия (рис. 5): Cl- ½ AgCl, Ag.
AgCl + e- = Ag + Cl-
В соответствии с уравнением (3.31), потенциал хлорсеребряного электрода рассчитывается следующим образом
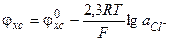 (3.35)
(3.35)
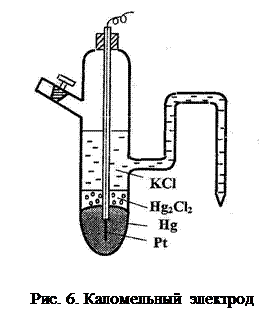
Каломельный электрод Cl- ½Hg2Cl2, Hg (рис. 6) представляет собой сосуд с впаянной платиновой проволокой, на дно которого наливается ртуть так, чтобы платина была ею покрыта. На поверхность ртути наносится паста из каломели (Hg2Cl2) и ртути и наливается раствор хлорида калия определенной концентрации.
 В таком электроде устанавливается равновесие
В таком электроде устанавливается равновесие
Hg2Cl2 + 2e- = 2Hg + 2Cl-
Исходя из уравнения потенциалопределяющей реакции, получим выражение для потенциала каломельного электрода:
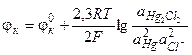 (3.36)
(3.36)
С учетом равенства единице активностей твердых веществ, уравнение для расчета потенциала каломельного электрода принимает вид, аналогичный соответствующему выражению для хлорсеребряного электрода
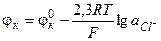 (3.37)
(3.37)
3. Окислительно-восстановительные электроды. К окислительно-восстановительным относят электроды, изготовленные из индифферентного (инертного) токопроводящего материала, погруженного в раствор, содержащий окисленную (Ox) и восстановленную (Red) формы какой-либо окислительно-восстановительной системы. В качестве индифферентных материалов могут выступать платина, золото, иридий, палладий, графит и др., при этом платина используется наиболее широко. Схема окислительно-восстановительного электрода записывается следующим образом:
Ox, Red ½Pt
Отличительной особенностью такого типа электродов является неучастие их материала в электродном процессе
Ox + ze- = Red,
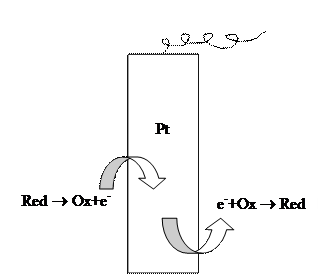 а также вытекающая отсюда независимость потенциала (уравнение 3.27) от материала электрода. Возникновение электродного потенциала в этом случае объясняется тем, что указанная реакция обмена электронами между Ox и Red – формами может протекать как непосредственно, так и через материал электрода. В результате в проводнике возникает ток электронов, называемый током обмена, обусловливающий возникновение избыточного заряда на электроде и, соответственно, электродный потенциал (рис. 7). Примером окислительно-восстановительного электрода является платиновая проволока, погруженная в раствор, содержащий хлориды олова (II) и (IV):
а также вытекающая отсюда независимость потенциала (уравнение 3.27) от материала электрода. Возникновение электродного потенциала в этом случае объясняется тем, что указанная реакция обмена электронами между Ox и Red – формами может протекать как непосредственно, так и через материал электрода. В результате в проводнике возникает ток электронов, называемый током обмена, обусловливающий возникновение избыточного заряда на электроде и, соответственно, электродный потенциал (рис. 7). Примером окислительно-восстановительного электрода является платиновая проволока, погруженная в раствор, содержащий хлориды олова (II) и (IV):
Sn4+, Sn2+ ïPt
Для данного электрода потенциал определяется по уравнению
 . (3.38)
. (3.38)
 Часто в окислительно-восстановительных реакциях в растворе принимают участие ионы водорода, тогда потенциал платинового электрода зависит также от величины pH. Такое свойство нашло применение при потенциометрическом измерении кислотности растворов с помощью хингидронного электрода. Хингидронный электрод получают, добавляя в исследуемый раствор хингидрон (эквимолекулярный комплекс хинона и гидрохинона) и погружая в него платиновую проволоку. Хингидрон в растворе диссоциирует на компоненты по схеме
Часто в окислительно-восстановительных реакциях в растворе принимают участие ионы водорода, тогда потенциал платинового электрода зависит также от величины pH. Такое свойство нашло применение при потенциометрическом измерении кислотности растворов с помощью хингидронного электрода. Хингидронный электрод получают, добавляя в исследуемый раствор хингидрон (эквимолекулярный комплекс хинона и гидрохинона) и погружая в него платиновую проволоку. Хингидрон в растворе диссоциирует на компоненты по схеме
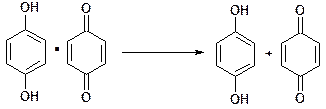
Хинон C6H4O2 и гидрохинон C6H4(OH)2 формируют органическую окислительно-восстановительную систему, в которой являются соответственно окисленной и восстановленной формами:
C6H4O2 + 2e- + 2H+ = C6H4(OH)2
 (3.39)
(3.39)
Учитывая, что концентрации, а, следовательно, и активности, хинона и гидрохинона в растворе равны, уравнение (3.39) упрощается:
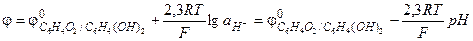 (3.40)
(3.40)
Потенциал хингидронного электрода является линейной функцией pH раствора, который можно рассчитать по уравнению (3.40).
4. Ионообменные (мембранные) электроды.
Ионообменные электроды состоят из внутреннего электрода второго рода (как правило, хлорсеребряного), отделенного от внешнего раствора мембраной из ионообменного материала (рис. 8):
Раствор ½мембрана ½Cl- ½AgCl, Ag
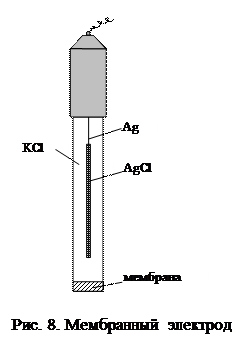 В настоящее время изготавливаются следующие типы мембран: стеклянные, кристаллические и пленочные. Механизм возникновения потенциала мембранных электродов, в отличие от электродов других типов, не связан с протеканием окислительно-восстановительных процессов. В его основе лежит обмен ионами между материалом мембраны и внешним раствором электролита:
В настоящее время изготавливаются следующие типы мембран: стеклянные, кристаллические и пленочные. Механизм возникновения потенциала мембранных электродов, в отличие от электродов других типов, не связан с протеканием окислительно-восстановительных процессов. В его основе лежит обмен ионами между материалом мембраны и внешним раствором электролита:
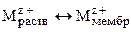 , или
, или
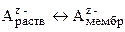
Избирательная сорбция некоторых ионов на поверхности мембраны приводит к появлению на ее поверхности заряда и формированию двойного электрического слоя на границе мембрана-раствор. Так как ионообменные материалы обладают селективностью по отношению к определенным ионам, электродный потенциал связан только с активностью данных ионов, вследствие чего ионообменные электроды принято называть также ионоселективными.
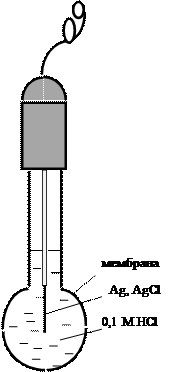
Среди мембранных электродов наибольшее распространение получил стеклянный электрод благодаря его уникальной селективности по отношению к ионам водорода, позволяющей измерять рН растворов в широком диапазоне даже в присутствии значительных количеств посторонних электролитов. Конструктивное отличие стеклянного электрода от других ионообменных электродов состоит в том, что стеклянная мембрана толщиной порядка 0,1 мм выдувается на конце толстостенной стеклянной трубки и имеет сферическую форму (рис. 9). В качестве внутреннего раствора используется 0,1 М соляная кислота либо буферный раствор с рН 7, содержащий хлорид-ионы. Стекло представляет собой аморфный полимерный силикатный материал, состоящий из пространственной кремнекислородной сетки, в полостях которой находятся катионы щелочных металлов (обычно Na+). Ионы водорода способны проникать из раствора в поверхностные слои стекла, обусловливая следующий потенциалопределяющий процесс:
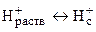
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 102; Нарушение авторских прав?; Мы поможем в написании вашей работы!