
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ему соответствует электродный потенциал, определяемый по уравнению
|
|
|
|
 (3.41)
(3.41)
В реальности, в ионном обмене на стеклянной мембране могут принимать участие также катионы натрия, способные покидать стекло и замещаться протонами:

 Обратная величина константы равновесия данной реакции является основной характеристикой стеклянной мембраны и называется константой обмена Kоб:
Обратная величина константы равновесия данной реакции является основной характеристикой стеклянной мембраны и называется константой обмена Kоб:
 (3.42)
(3.42)
Величина константы обмена для большинства сортов стекла лежит в диапазоне 10-11…10-14. Суммарная активность катионов в стекле остается постоянной, т.е.
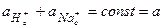 (3.43)
(3.43)
Тогда
 (3.44)
(3.44)
 (3.45)
(3.45)
Подставляя выражение (3.45) в уравнение для потенциала стеклянного электрода (3.41), получим
 (3.46)
(3.46)
Так как величина a постоянна, внесем ее в стандартный электродный потенциал:
 (3.47)
(3.47)
 Таким образом, в общем случае потенциал стеклянного электрода зависит как от активности ионов водорода, так и от активности щелочного металла в растворе. В зависимости от соотношения слагаемых под знаком логарифма, возможны два предельных случая:
Таким образом, в общем случае потенциал стеклянного электрода зависит как от активности ионов водорода, так и от активности щелочного металла в растворе. В зависимости от соотношения слагаемых под знаком логарифма, возможны два предельных случая:
а) при  (рН £ 12)
(рН £ 12)  , тогда потенциал электрода определяется только активностью ионов водорода в растворе и является линейной функцией рН:
, тогда потенциал электрода определяется только активностью ионов водорода в растворе и является линейной функцией рН:
 (3.48)
(3.48)
б) в сильнощелочных средах (рН > 12…14) активность протонов крайне мала, в то же время велика активность катионов щелочного металла, поступающих в раствор со щелочью, поэтому  и
и
 (3.49)
(3.49)
В этом случае потенциал стеклянного электрода определяется не активностью ионов водорода, а активностью катионов щелочного металла. Другими словами, в концентрированных растворах щелочей стеклянный электрод приобретает металлическую электродную функцию, что приводит к отклонению от линейной зависимости в координатах jс – рН. Такое отклонение принято называть щелочной ошибкой стеклянного электрода.
|
|
|
В сильнокислых средах при рН < 1 нернстовская электродная функция, выражаемая уравнением (3.48), также нарушается. Это явление связано с адсорбцией на стекле анионов кислоты и, по аналогии со щелочной ошибкой, получило название кислотной ошибки стеклянного электрода.
В связи с этим, зависимость потенциала стеклянного электрода от рН раствора имеет вид, представленный на рис. 10.
Гальванические элементы
Если два электрода, погруженных в растворы электролитов, соединить металлическим проводником и обеспечить контакт между растворами, за счет разности электродных потенциалов в системе будет протекать электрический ток, при этом источником электрической энергии будет являться химическая реакция. Такая электрохимическая система, превращающая энергию химических процессов в электрическую работу, получила название гальванического элемента.
Сущность гальванического элемента заключается в пространственном разделении химической реакции на две окислительно-восстановительные полуреакции, протекающие на электродах, за счет чего электроны, участвующие в реакции, должны перемещаться по внешней цепи, совершая по пути полезную работу. При этом на электроде с меньшим потенциалом (отрицательном) протекает реакция окисления, а на электроде с большим потенциалом (положительном) – реакция восстановления. Электрод, на котором идет восстановление называют катодом, а электрод, на котором протекает окисление – анодом.
Для описания устройства гальванических элементов аналогично отдельным электродам применяется условная запись – схема гальванического элемента, в соответствии с которой последовательно записываются все фазы, имеющиеся в гальваническом элементе, при этом слева указывается материал анода. В такой записи электроды отделяются от раствора сплошной вертикальной линией, а растворы разделяются либо пунктирной линией, когда их контакт обеспечивается пористой перегородкой, либо двумя вертикальными линиями в случае использования солевых мостиков – трубок, заполненных раствором электролита, как правило, загущенным добавлением полисахарида агар-агара (агаровые мостики).
|
|
|
Рассмотрим работу гальванического элемента на примере медно-цинкового гальванического элемента (элемента Даниэля-Якоби). Он представляет собой комбинацию двух электродов первого рода - цинкового, погруженного в раствор сульфата цинка, и медного, находящегося в растворе сульфата меди (рис. 11). Цинк является более активным металлом, чем медь (j0 системы Zn2+/Zn составляет -0,764 В, а для системы Cu2+/Cu +0,336 В), поэтому в данном гальваническом элементе он является анодом. В соответствии с изложенными правилами, схема элемента Даниэля-Якоби записывается следующим образом:
(-) Zn½ZnSO4 ïïCuSO4 ½Cu (+)


Рис. 11. Медно-цинковый элемент
При замыкании электродов цинк окисляется, превращаясь в катионы Zn2+, освободившиеся при этом электроны переходят по внешней цепи на медный электрод, где взаимодействуют с ионами Cu2+, восстанавливая их до металлической меди. Образовавшийся избыток анионов в катодном пространстве устраняется их миграцией в анодное через жидкостное соединение (солевые мостики). Таким образом, на аноде и катоде идут следующие реакции:
А: Zn - 2e- ® Zn2+
К: Cu2+ + 2e- ® Cu
Суммируя эти процессы с учетом баланса электронов получим уравнение реакции, протекающей в гальваническом элементе:
Zn + Cu2+ ® Zn2+ + Cu
ЭДС гальванического элемента
Основной характеристикой любого гальванического элемента является его электродвижущая сила (ЭДС). Эта величина представляет собой алгебраическую сумму скачков потенциала на всех границах раздела фаз в гальваническом элементе. Рассмотрим следующую схему гальванического элемента:
(-) Электрод 1 ï Раствор 1∶ Раствор 2 ï Электрод 2 (+)
Двигаясь слева направо, запишем выражение для ЭДС в соответствии с указанным правилом:
 (3.50)
(3.50)
Второе слагаемое в правой части выражения (3.50) представляет собой скачок потенциала на границе двух растворов электролитов, обусловленный диффузией ионов в соседнюю фазу, и называемый диффузионным потенциалом. Величина диффузионного потенциала возрастает при увеличении различия в подвижностях ионов, переносящих электрический ток внутри гальванического элемента, и, в некоторых случаях, может достигать нескольких десятков милливольт. Так как точно определить диффузионный потенциал невозможно, его либо устраняют, используя гальванические элементы с одним раствором электролита, в который погружены оба электрода (элементы без переноса), либо сводят к незначительной величине, используя солевые мостики, наполненные раствором хлорида калия. Так как подвижности ионов K+ и Cl- очень близки, диффузионный потенциал в этом случае не превышает десятых долей милливольта и им можно пренебречь. Тогда уравнение (3.50) записывается в виде:
|
|
|
 (3.51)
(3.51)
Скачки потенциала на границах электрод – раствор представляют собой электродные потенциалы, при этом, в соответствии с правилами записи схем электродов (слева располагается раствор, справа – электрод), 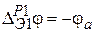 и
и  , т. е.
, т. е.
 (3.52)
(3.52)
ЭДС гальванического элемента равна разности потенциалов катода и анода. Например, для медно-цинкового элемента, в соответствии с уравнением (3.29)
 ,
, 

или
 (3.53)
(3.53)
В уравнении (3.53)  является стандартной ЭДС гальванического элемента, то есть представляет собой ЭДС такого гальванического элемента, в котором активности потенциалопределяющих ионов равны единице.
является стандартной ЭДС гальванического элемента, то есть представляет собой ЭДС такого гальванического элемента, в котором активности потенциалопределяющих ионов равны единице.
Так как выражения для потенциалов электродов определяются протекающими на них электродными реакциями, ЭДС гальванического элемента можно найти на основе уравнения протекающего в нем суммарного процесса. В общем виде, для некоторой реакции

где ni – стехиометрические коэффициенты; A, B, C, D – реагенты
 (3.54)
(3.54)
где n – общее число электронов, участвующих в суммарной реакции.
Данное уравнение является основным уравнением равновесной электрохимии и называется уравнением Нернста. Записав его для реакции в медно-цинковом гальваническом элементе и, учитывая равенство единице активностей меди и цинка в кристаллическом состоянии, получим уравнение (3.53).
|
|
|
ЭДС гальванического элемента является термодинамической величиной, характеризующей протекающую в нем реакцию, поэтому связана с другими термодинамическими параметрами процесса и, в первую очередь, с энергией Гиббса:
 (3.55)
(3.55)
Аналогично
 (3.56)
(3.56)
Так как величина DG0 по уравнению изотермы химической реакции связана с константой равновесия K
 (3.57)
(3.57)
то измерение стандартной эдс позволяет легко ее рассчитать, сопоставив уравнения (3.56) и (3.57):
 или
или  (3.58)
(3.58)
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 79; Нарушение авторских прав?; Мы поможем в написании вашей работы!