
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гетерогенные химические равновесия
|
|
|
|
Равновесия в системах, в которых протекают реакции с веществами, находящимися в разных фазах, называются гетерогенными химическими равновесиями.
Гетерогенные химические реакции могут включать газовую фазу и конденсированные фазы – твердые или жидкие. Наиболее простым (однако часто встречающимся) случаем является равновесие между газовой фазой (г.ф.) и конденсированными фазами постоянного состава (к.ф.п.с.). В этом случае твердые или жидкие вещества не образуют растворов, т. е. не растворимы друг в друге. Химический потенциал конденсированной фазы постоянного состава (обычно чистые твердые и жидкие вещества) равен ее молярной энергии Гиббса и при постоянном давлении является функцией только температуры.
Пусть в системе протекает гетерогенная реакция с участием газообразных веществ и кристаллических фаз постоянного состава
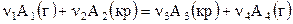 .
.
При установлении равновесия
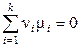 . (11.34)
. (11.34)
Химические потенциалы кристаллических фаз при постоянном давлении зависят только от температуры:
 ,
, 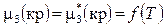 . (11.35)
. (11.35)
Если газовая фаза идеальна, то химические потенциалы газообразных участников определяются следующими выражениями:
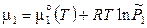 ,
, 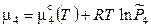 . (11.36)
. (11.36)
После подстановки выражений (11.35) и (11.36) в уравнение (11.34) и некоторых преобразований получаем:
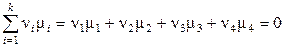 ,
,
 ,
,
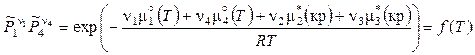 ,
,
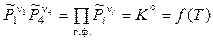 . (11.37)
. (11.37)
Таким образом, в выражение для стандартной константы равновесия гетерогенной реакции входят только относительные парциальные давления газообразных реагентов. Аналогичным образом записывается и энергия Гиббса подобной реакции:
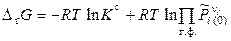 . (11.38)
. (11.38)
Например, для реакций
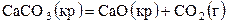 ;
;
 ;
;
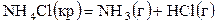
константы равновесия равны соответственно
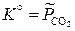 ,
,  ;
;
 ,
, 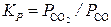 ;
;
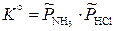 ,
, 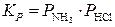 .
.
Если в гетерогенных реакциях принимают участие конденсированные фазы переменного состава (жидкие и твердые растворы), то закон действующих масс выражается через относительные парциальные давления газообразных веществ и активности (или мольные доли, если растворы идеальные) компонентов конденсированных фаз. Это связано с тем, что химические потенциалы газообразных участников реакции определяются выражением
 ,
,
а компонентов жидких и твердых реальных растворов – выражением
 .
.
Например, для реакции

стандартная константа равновесия равна
 .
.
Если химическая реакция протекает между конденсированными фазами постоянного состава, например
 ,
,
то при постоянных давлении и температуре
 ,
, 
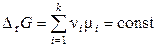 .
.
Следовательно, реакция будет протекать до конца только в одном направлении – в сторону уменьшения энергии Гиббса.
11.7. Смещение равновесия. Принцип Ле-Шателье – Брауна
Химические равновесия являются динамичными и подвижными. При изменении внешних условий равновесие смещается в сторону прямой или обратной реакций. Если после этого внешние параметры возвращаются к исходным значениям, то и равновесие приходит в исходное состояние. Впервые (1885) принцип смещения равновесия сформулировал Ле-Шателье: равновесная система реагирует на внешнее воздействие таким образом, чтобы уменьшить это воздействие. Теоретически этот принцип был обоснован Ф. Брауном (1887).
Математически принцип Ле-Шателье – Брауна может быть представлен в виде следующего неравенства:
 , если
, если 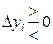 , (11.39)
, (11.39)
где Xi – обобщенная сила, yi – сопряженная данной силе обобщенная координата.
Неравенство (11.39) имеет следующий смысл: изменение обобщенной силы Xi (интенсивный параметр) при постоянстве всех остальных сил (Xj) смещает химическое равновесие в таком направлении, при котором изменение сопряженной обобщенной координаты Δ yi препятствует изменению обобщенной силы.
Если рассматривать влияние на химическое равновесие температуры (при постоянстве остальных интенсивных параметров), то в качестве сопряженной координаты используют тепловой эффект реакции:
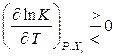 , если
, если  , (11.40)
, (11.40)
Повышение (понижение) температуры системы смещает равновесие в том направлении, в котором поглощается (выделяется) теплота.
При изменении давления (обобщенной силы) сопряженной координатой будет объем (взятый с обратным знаком). Давление и объем изменяются антибатно, поэтому
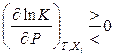 , если
, если 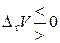 . (11.41)
. (11.41)
Повышение (понижение) давления смещает равновесие в сторону реакции, протекающей с уменьшением (увеличением) объема.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 3328; Нарушение авторских прав?; Мы поможем в написании вашей работы!