
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние давления на химическое равновесие
|
|
|
|
Для реакций с идеальными газами стандартная константа равновесия является функцией только температуры и не зависит от давления:
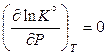 . (11.48)
. (11.48)
Однако это не означает, что при изменении общего давления количество веществ, находящихся в равновесии, обязательно не изменится. Найдем аналитическую зависимость константы равновесия Ky от давления. Согласно уравнению (11.20)
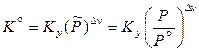 .
.
Преобразуем это выражение:
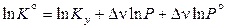 ,
,
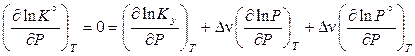 .
.
Поскольку стандартное давление не зависит от давления в системе, то
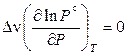 .
.
Следовательно,
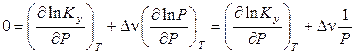 ,
,
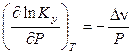 (11.49)
(11.49)
Полученное уравнение называют уравнением Планка – Ван-Лаара.
Общее давление в системе всегда положительно, поэтому
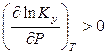 , если
, если 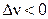 ,
,
т. е. константа равновесия Ky и выход продуктов реакции будут увеличиваться с ростом давления для реакций, протекающих с уменьшением числа молей газообразных веществ, и наоборот.
Для реакций с идеальными газами при постоянных давлении и температуре
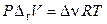 ,
,
тогда
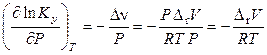 . (11.50)
. (11.50)
где Δr V – изменение объема системы при протекании реакции. Итак,
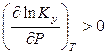 , если
, если 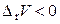 .
.
Выход продуктов увеличивается с повышением давления для реакций, при протекании которых объем системы уменьшается.
Согласно уравнениям (11.49) и (11.50) для идеально-газовой реакции, в ходе которой число молей веществ не изменяется (Δν = 0), давление не влияет на состав равновесной смеси.
Рассмотрим вопрос о том, как влияет введение инертного идеального газа в систему на состав равновесной смеси при постоянной температуре. Если инертный газ вводится при постоянном объеме, то состав равновесной смеси не изменится, так как останутся постоянными равновесные парциальные давления участников реакции.
Если инертный газ вводится при постоянном давлении, то общее давление газов, участвующих в реакции, уменьшится. Тогда, согласно уравнению Планка – Ван-Лаара, если реакция протекает с увеличением числа молей, то константа равновесия и выход продуктов реакции увеличиваются:
если 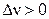 , то
, то 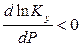 ; тогда
; тогда 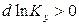 при
при 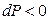 .
.
И наоборот:
если 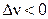 , то
, то 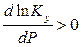 ; тогда
; тогда 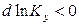 при
при 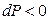 .
.
Наконец, если число молей газов в ходе реакции не изменяется, то введение инертного газа не оказывает влияния на состав равновесной смеси.
Для реакций с веществами в конденсированном состоянии изменение объема незначительно и давление, как правило, мало влияет на состояние химического равновесия.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 5209; Нарушение авторских прав?; Мы поможем в написании вашей работы!