
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Законы Гиббса-Коновалова
|
|
|
|
Законы Гиббса-Коновалова (1881 г.) установливают соотношения между составами равновесных жидких растворов и составами их паров, а также общим давлением насыщенного пара над ними.
Первый закон Гиббса-Коновалова гласит: в насыщенном паре над раствором преобладает по сравнению с раствором тот компонент, добавление которого к раствору приводит к возрастанию общего давления насыщенного пара (пар обогащен легколетучим компонентом). Данный закон выполняется для любых растворов, а на рассматриваемом явлении основана фракционная перегонка (ректификация), позволяющая разделить смесь взаимно-растворимых жидкостей.
Докажем первый закон Гиббса-Коновалова, для чего воспользуемся уравнением Дюгема-Маргулеса (8.10), устанавливающим связь между изменениями парциальных давлений пара компонентов и составом раствора при постоянных температуре и давлении. В расчете на 1 моль жидкого бинарного раствора указанное уравнение принимает вид
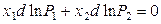 .
.
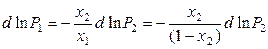 . (8.35)
. (8.35)
Преобразуем уравнение (8.35):
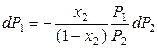 . (8.36)
. (8.36)
Учтем, что
 ,
,  ,
,
тогда
 . (8.37)
. (8.37)
Поскольку
 ,
,  ,
,
то
 . (8.38)
. (8.38)
Разделим правую и левую части уравнения (8.38) на dx 2, получим:
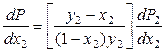 . (8.39)
. (8.39)
Поскольку производная (dP 2/ dx 2) > 0 (парциальное давление второго компонента в паре увеличивается с ростом его мольной доли в растворе), то знак производной (dP / dx 2) определяется знаком разности (y 2 – x 2). Если y 2 > x 2, то (dP / dx 2) > 0, что и требовалось доказать.
С учетом вышеизложенного первый закон Гиббса-Коновалова может быть сформулирован и так: общее давление пара над раствором растёт с ростом доли в растворе того компонента, который богаче представлен в паре (более летучего компонента).
Второй закон Гиббса-Коновалова касается более частных случаев и выполняется для реальных растворов с большими отклонениями от закона Рауля, на кривых «общее давление пара – состав» для которых имеются минимумы или максимумы. Второй закон Гиббса-Коновалова гласит: максимум на кривой общего давления соответствует минимуму на кривой температур кипения и отвечает такому равновесию раствора и насыщенного пара, при котором составы фаз одинаковы, и наоборот.
Экстремумы на кривой зависимости общего давления насыщенного пара от состава раствора удовлетворяют условию (dP / dx 2) = 0, а в соответствии с уравнением (8.39) это возможно, только если в этих точках y 2 = x 2. Итак, в экстремумах общего давления пара (или температур кипения) раствор и насыщенный пар имеют одинаковый состав.
Возможные диаграммы состояния бинарных систем с максимумом на кривой давления пара и минимумом на кривой температур кипения представлены на рис. 8.7.

Рис. 8.7. Диаграммы состояния бинарных систем с максимумом на кривой давления пара (а) и минимумом на кривой температур кипения (б).
Смеси, у которых раствор и пар одинаковы по составу, называются азеотропными, или нераздельнокипящими. Путём перегонки азеотропные растворы не разделяются (составы фаз равны). Но их можно разделить следующими методами:
— путём химического связывания одного из компонентов;
— путем добавления в систему третьего компонента;
— путем ректификации на двух последовательных колонках при различных давлениях.
Примерами азеотропных смесей с минимумами на кривых температур кипения являются растворы, содержащие Н2О и С2Н5ОН (96,5%), метанол и ацетон. Примерами азеотропных смесей с максимумами на кривых кипения являются растворы, содержащие Н2О и НСl (20%), ацетон и хлороформ.
Третий закон Гиббса-Коновалова гласит: в изотермических или изобарических условиях состав насыщенного пара и состав жидкого раствора меняются синбатно (составы обеих фаз меняются в одном направлении). Данный закон логично следует из изученного материала и для его обоснования достаточно еще раз внимательно изучить диаграммы состояния, представленные, например, на рис. 8.3 – 8.5.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 12587; Нарушение авторских прав?; Мы поможем в написании вашей работы!