
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон эквивалентов
|
|
|
|
Закон о растворимости компонентов газовой смеси: при постоянной температуре растворимость в данной жидкости каждого из компонентов газовой смеси, находящейся над жидкостью, пропорциональна их парциальному давлению
Закон о суммарном давлении смеси газов: давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений газов, составляющих смесь
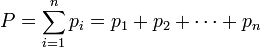

Оба закона Дальтона строго выполняются для идеальных газов. Для реальных газов эти законы применимы при условии, если их растворимость невелика, а поведение близко к поведению идеального газа.
Количество элемента или вещества, которое взаимодействует с 1 молем атомов водорода (1 г) или замещает это количество водорода в химических реакциях, называется эквивалентом данного элемента или вещества (Э).
Эквивалентной массой (Мэ, г/моль) называется масса одного эквивалента вещества.
Эквивалентную массу можно вычислить по составу соединения, если известны мольные массы (М):
1) Мэ(элемента): Мэ = А/В,
где А - атомная масса элемента, В - валентность элемента;
2) Мэ(оксида) =М/2n(О2) = Мэ(элем.) + Мэ(О2) = Мэ(элем.) + 8,
где n(О2) - число атомов кислорода; Мэ(О2) = 8 г/моль - эквивалентная масса кислорода;
3) Мэ(гидроксида) = М/n(он-) = Мэ(элем.) + Мэ(ОН-) = Мэ(элем.) + 17,
где n(он-) - число групп ОН-; Мэ(ОН-) = 17 г/моль;
4) Мэ(кислоты) = М/n(н+) = Мэ(Н+) + Мэ(кисл. ост.) = 1 + Мэ(кисл. ост.),
где n(н+) - число ионов Н+; Мэ(Н+) = 1 г/моль; Мэ(кисл. ост.) – эквивалентная масса кислотного остатка;
5) Мэ(соли) = М/nмеВме = Мэ(элем.) + Мэ(кисл. ост.),
где nме - число атомов металла; Вме - валентность металла.
При решении некоторых задач, содержащих сведения об объемах газообразных веществ, целесообразно пользоваться значением эквивалентного объема (Vэ).
Эквивалентным объемом называется объем, занимаемый при данных условиях
1 эквивалентом газообразного вещества. Так для водорода при н.у. эквивалентный объем равен 22,4•1/2 = 11,2 дм3, для кислорода - 5,6 дм3.
Согласно закону эквивалентов: массы (объемы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объемам)
m1/Mэ1 = m2/Mэ2.
Если одно из веществ находится в газообразном состоянии, тогда
m/Мэ = Vо/Vэ.
Если оба вещества находятся в газообразном состоянии
Vо1 /Vэ 1 = Vо2 /Vэ2.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 725; Нарушение авторских прав?; Мы поможем в написании вашей работы!